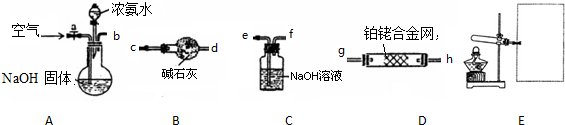题目内容
17.下列说法错误的是( )| A. | 除去FeSO4溶液中的CuSO4可加入适量铁粉,再过滤 | |
| B. | 通过灼热的CuO除去H2中的CO | |
| C. | 除去NaCl中少量的Na2SO4可依次加入BaCl2、Na2CO3、HCl溶液 | |
| D. | 除去溴苯中的溴,可用NaOH溶液洗涤,再分液 |
分析 A.Fe与硫酸铜反应生成硫酸亚铁和Cu;
B.氢气、CO均可还原CuO;
C.氯化钡与硫酸钠反应生成硫酸钡沉淀,过量的氯化钡利用碳酸钠除去,过量的碳酸钠利用盐酸除去;
D.溴与NaOH溶液反应后,与溴苯分层.
解答 解:A.Fe与硫酸铜反应生成硫酸亚铁和Cu,Fe、Cu不溶于水,然后过滤可除杂,故A正确;
B.氢气、CO均可还原CuO,将原物质反应掉,不符合除杂的原则,故B错误;
C.氯化钡与硫酸钠反应生成硫酸钡沉淀,过量的氯化钡利用碳酸钠除去,过量的碳酸钠利用盐酸除去,则除去NaCl中少量的Na2SO4可依次加入BaCl2、Na2CO3、HCl溶液,故C正确;
D.溴与NaOH溶液反应后,与溴苯分层,然后分液可除杂,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.下列物质中既含有离子键又含有共价键的是( )
| A. | Na2O | B. | MgCl2 | C. | CH3COOH | D. | NaOH |
8.关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是( )
| A. | 化学平衡常数反映了在一定温度下可逆反应可能进行的限度 | |
| B. | 四种平衡常数都是温度的函数,温度升高其数值都增大 | |
| C. | 一个可逆反应的化学平衡常数和参与反应的每种物质的化学计量数都有关系 | |
| D. | 纯水中加入强酸或强碱,水的离子积常数都会减小 |
5.下列属于复分解反应的是( )
| A. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | 3Cl2+6NaOH═5NaCl+NaClO3+3H2O | |
| D. | 2HCl+CaCO3═CaCl2+CO2↑+H2O |
12.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 31g白磷中含有的共价键数目为1.5NA | |
| B. | 0.1L3.0mol•L-1的NH4N03溶液中含有的NH4+的数目为0.3NA | |
| C. | 标准状况下,22.4L己烷中含共价键数目为19NA | |
| D. | 常温常压下,lmolCl2与足量的水充分反应,转移的电子数目为NA |
2.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )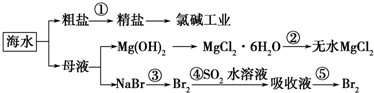

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩 |
6.在下列各溶液中,离子一定能大量共存的是( )
| A. | 碱性溶液中:K+、Mg2+、S2-、ClO- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、HCO3-、SO42- |
4.阿伏加德罗曾做过这样一个实验:“一抽空的密闭容器重Mg,在标准状况下,盛满CH4气体后,称重为(M+Q ) g.把CH4气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的边托盘上置砝码 …”横线上分别应填的是( )
| A. | 右;( M+2Q) | B. | 右;(M+4Q ) | C. | 左;(M+2Q) | D. | 左;(M+4Q) |