题目内容
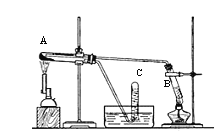
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。
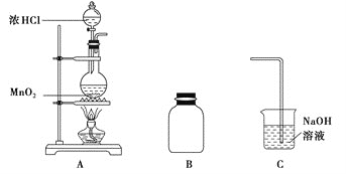
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
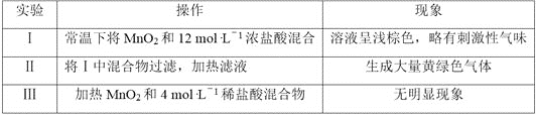
①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
【答案】还原性 HCl、H2O(g) 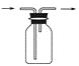 Cl2+2OH-=Cl-+ClO-+H2O MnO2+4HCl=MnCl4+2H2O MnCl4=Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
Cl2+2OH-=Cl-+ClO-+H2O MnO2+4HCl=MnCl4+2H2O MnCl4=Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
【解析】
(1)二氧化锰和浓盐酸在加热的条件下反应生成氯气,元素失电子化合价升高发生氧化反应,元素得电子化合价降低发生还原反应;
(2)MnO2与浓盐酸反应制取Cl2中混有氯化氢和水蒸气;
(3)氯气的密度比空气的密度大,采用向上排空气法收集氯气;
(4)C中氢氧化钠溶液用于吸收多余的Cl2,生成氯化钠、次氯酸钠和水;
(5)①复分解反应为两种化合物相互交换成分生成另外两种化合物;
②将Ⅰ中混合物过滤,加热滤液,Ⅱ中发生了分解反应,结合氧化还原反应单质守恒分析锰元素被还原的价态和物质;
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将ⅰ、ⅱ做对比加热MnO2和4mo![]() L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度。
L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度。
(1)二氧化锰和浓盐酸在加热的条件下反应生成氯气,氯元素化合价升高,锰元素的化合价降低,氯化氢做还原剂,利用氯化氢的还原性;
(2)用MnO2与浓盐酸在加入条件下反应制取Cl2,浓盐酸中的氯化氢易挥发,故Cl2含有杂质为HCl、H2O(g);
(3)氯气的密度比空气的密度大,采用向上排空气法,长导管进气,短导管出气,收集氯气的装置图为: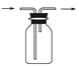 ;
;
(4)C用于吸收多余的Cl2,防止污染环境,C中发生反应的离子方程式是:Cl2+2OH-![]() Cl-+ClO-+H2O;
Cl-+ClO-+H2O;
(5)①MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,酸碱中和反应生成盐和水,化学方程式是:MnO2+ 4HCl=MnCl4+2 H2O;
②Ⅱ中发生了分解反应,将Ⅰ中混合物过滤,加热滤液分解生成MnCl2和Cl2,反应的化学方程式是:MnCl4= MnCl2+Cl2↑;
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验Ⅲ、Ⅳ作对比,得出的结论是Ⅲ中无明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度,才能被MnO2氧化,将ⅰ、ⅱ作对比,加热MnO2和4mo![]() L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。
L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应