题目内容
六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是: 。
(2)A、C形成的四原子核化合物甲的电子式为 ,该化合物呈弱酸性,试写出这种化合物的电离方程式: 。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式: 。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式: 。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式: 。
(6)A、E形成的四原子核化合物丙容易液化,其原因是: 。
(1)SO32-+H2O HSO3-+OH-(HSO3-+H2O
HSO3-+OH-(HSO3-+H2O H2SO3+OH-)(写对第一级即可)
H2SO3+OH-)(写对第一级即可)
(2)  H2O2
H2O2 HO2-+H+
HO2-+H+
(3)H++HSO3-=SO2↑+H2O
(4)H2O2+H2SO3??H2SO4+H2O
(5)Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓
(6)分子间形成氢键,增加了分子之间的作用力,使之易液化。
解析

(11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下: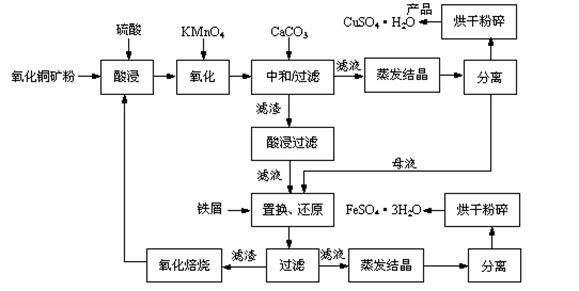
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
(6)下表和下图为“烘干粉碎”的试验结果。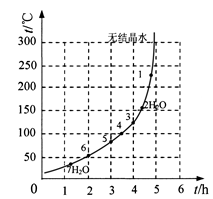
硫酸亚铁干燥曲线图
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
表2.硫酸铜晶体(CuSO4·5H2O)干燥试验表
表2中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O和FeSO4·7H2O脱水得流程中所示产品的适宜工艺条件分别为 , (分别指出两条件的温度和时间)。
某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| | 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 | | | | |
(2)待测溶液中是否有SO32-、SO42- 。若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为 ,形成沉淀B时反应的离子方程式为 。
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是 。
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
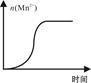
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
 、
、 两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作: