题目内容
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)

A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
【答案】C
【解析】
向某NaOH溶液中通入CO2气体,涉及反应及产物分别为:2NaOH+CO2=Na2CO3+H2O(CO2+2OH-=CO32-+H2O);NaOH+CO2=NaHCO3(OH―+CO2═HCO3―);向M溶液加入盐酸时发生的反应可能为:CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑;根据以上反应规律进行分析。
向某NaOH溶液中通入CO2气体,涉及反应及产物分别为:2NaOH+CO2=Na2CO3+H2O(CO2+2OH-=CO32-+H2O);NaOH+CO2=NaHCO3(OH―+CO2═HCO3―);M溶液加入盐酸时发生的反应可能为:CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑;在不同的物质的量比的范围内产物(溶液M的成份)不同,参见下图:设a=n(CO2)/n(NaOH),则:
a | M的成分 | OB与BC的关系 |
a<1:2 | NaOH 和 Na2CO3 | OB>BC |
a=1:2 | Na2CO3 | OB=BC |
1:2<a<1:1 | NaHCO3和Na2CO3 | OB=BC |
a≥1:1 | NaHCO3 | OB=0 |
由上表可知,若3OB=BC,则溶液M的成分为NaHCO3和Na2CO3,可得:3n(Na2CO3)=n(Na2CO3)+n(NaHCO3)即:c(NaHCO3)=2c(Na2CO3),综上所述A、B、D正确,C错误;正确选项C。

 名校课堂系列答案
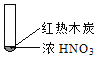
名校课堂系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应