题目内容
【题目】下图为元素周期表的一部分:
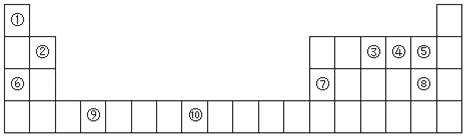
I.(1)元素③的基态原子轨道表示式为_________________。
(2)元素③④⑤的第一电离能由大到小的顺序为___________(填元素符号)。
(3)以下组合的原子间反应最容易形成离子键的是_____(选填A、B、C、D,下同)。
A.②和⑤ B.和⑤ C.⑤和⑥ D.⑥和⑧
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________。
II.(1)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。
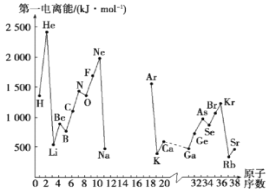
①根据同图示变化规律,可推测S的第一电离能的大小(最小)范围为___< S <___ (填元素符号)
②图中第一电离能最小的元素在周期表中的位置 ____________________
(2)用In表示元素的第n电离能,则图中的a、b、c分别代表(__________)
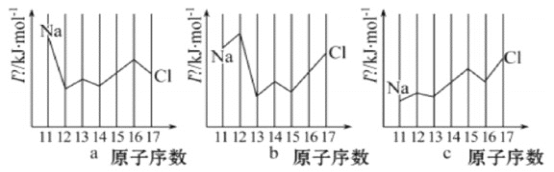
A.a为I1、b为I2、c为I3 B.a为I3、b为I2、c为I1
C.a为I2、b为I3、c为I1 D.a为I1、b为I3、c为I2
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________________________________________
【答案】![]() F>N>O C 2OH﹣+BeO=BeO22﹣+H2O Si P 第五周期IA族 C Cu原子失去一个电子后,核外电子排布为
F>N>O C 2OH﹣+BeO=BeO22﹣+H2O Si P 第五周期IA族 C Cu原子失去一个电子后,核外电子排布为![]() ,而锌为[Ar]3d104s1,根据洪特则,铜达到了较稳定状态,所以Cu的第二电离能相对较大
,而锌为[Ar]3d104s1,根据洪特则,铜达到了较稳定状态,所以Cu的第二电离能相对较大
【解析】
根据元素在周期表中的位置可知,①至⑩号元素分别为H,Be,N,O,F,Na,Al,Cl,Ti,Fe。
Ⅰ(1)由图可知,③为N元素,基态原子电子排布式为:1s22s22p3,则基态原子轨道表示式为:![]() ;
;
(2)同一周期第一电离能随原子序数增大呈现增大的趋势,但同一周期第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大,所以N,O,F三种元素的第一电离能从大到小次序为F>N>O;
(3)由周期表中的位置可知,①为H,②Be,⑤为F,⑥为Na,⑧为Cl,五种元素中最活泼的金属钠和最活泼的非金属氟之间最容易形成离子键,C项正确;答案选C;
(4)由于Be与Al的性质相似,所以参照Al2O3与NaOH溶液的反应,BeO与NaOH溶液反应的离子方程式为:![]() ;
;
Ⅱ(1)①同一周期第一电离能随原子序数增大呈现增大的趋势,但同一周期第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大;所以S的第一电离能大于Si,小于P;
②金属性越强,越容易失去电子,第一电离能越小,图中第一电离能最小的元素是铷,在第五周期ⅠA族;
(2) a中Na元素的电离能远大于Mg的电离能,则a应表示的是I2;b中Na元素的电离能小于Mg的电离能,Mg的电离能远大于Al的电离能,则b应表示的是I3;c中Al元素的电离能小于Mg的电离能,S元素的电离能小于P的电离能,并且从N到Cl,电离能呈现较明显的增加的趋势,则c应表示的是I1,C项正确;
答案选C;
(3) Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特则,铜达到了较稳定状态,所以Cu的第二电离能相对较大;