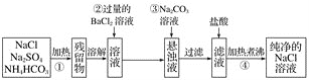
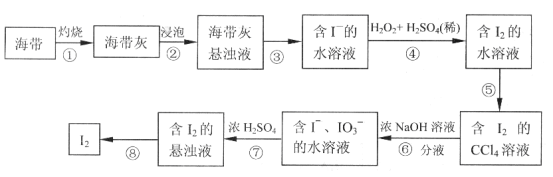
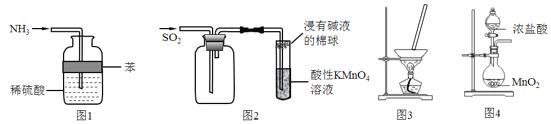
题目内容
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、千燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A.K一定存在B.100mL溶液中含0.01 mol CO32-
C.Cl-可能存在D.Ba2+一定不存在,Mg2+可能存在
【答案】AC
【解析】
①第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生的离子有:Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生0.04mol气体,该气体是氨气,故溶液中一定含有0.04mol NH4+;
③不溶于盐酸的2.33g沉淀为硫酸钡,物质的量为:![]() =0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为:
=0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为:![]() =0.02mol,故原溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+,可能含有Cl-;
=0.02mol,故原溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+,可能含有Cl-;
A.由分析可知,原溶液中n(SO42-)=0.01mol、n(CO32-)=0.02mol、n(NH4+)=0.04mol,由于溶液显电中性,2 n(SO42-)+2n(CO32-)=0.06mol> n(NH4+)=0.04mol,因此原溶液中,一定含有K+,且其物质的量n(K+)≥0.02mol,A符合题意;
B.由分析可知,原溶液中n(CO32-)=0.02mol,B不符合题意;
C.由分析可知,原溶液中可能含有Cl-,C符合题意;
D.由分析可知,原溶液中一定不含有Mg2+、Ba2+,D不符合题意;
故答案为:AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图为元素周期表的一部分:
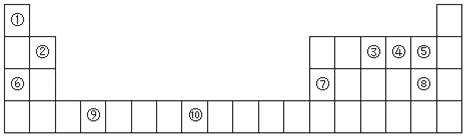
I.(1)元素③的基态原子轨道表示式为_________________。
(2)元素③④⑤的第一电离能由大到小的顺序为___________(填元素符号)。
(3)以下组合的原子间反应最容易形成离子键的是_____(选填A、B、C、D,下同)。
A.②和⑤ B.和⑤ C.⑤和⑥ D.⑥和⑧
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________。
II.(1)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。
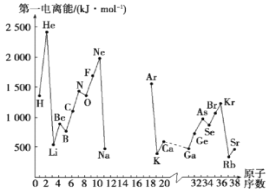
①根据同图示变化规律,可推测S的第一电离能的大小(最小)范围为___< S <___ (填元素符号)
②图中第一电离能最小的元素在周期表中的位置 ____________________
(2)用In表示元素的第n电离能,则图中的a、b、c分别代表(__________)
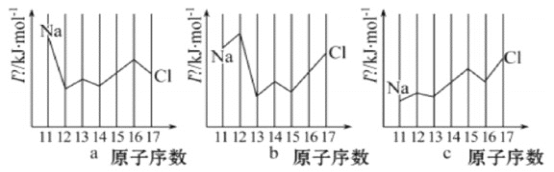
A.a为I1、b为I2、c为I3 B.a为I3、b为I2、c为I1
C.a为I2、b为I3、c为I1 D.a为I1、b为I3、c为I2
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能 | I1 | I2 |
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________________________________________