题目内容
【题目】钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的 (填“Na2O”或“Na2O2”);
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种 (填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的化学方程式: 。
【答案】(1)Na2O2
(2)两性
(3)Fe(OH)3 +3HCl=FeCl3+3H2O
【解析】
试题分析:(1)钠在空气中燃烧2Na+O2![]() Na2O2,观察到发出黄色的火焰,生成淡黄色固体Na2O2,故答案为:Na2O2;
Na2O2,观察到发出黄色的火焰,生成淡黄色固体Na2O2,故答案为:Na2O2;
(2)既能和酸反应生成盐和水又能和碱反应生成盐和水的氧化物叫两性氧化物,Al2O3与酸、碱反应生成盐与水,属于两性氧化物,故答案为:两性;
(3)Fe(OH)3与盐酸发生中和反应,两种化合物相互交换成分,生成氯化铁和水,反应为:Fe(OH)3+3HCl=FeCl3+3H2O,故答案为:Fe(OH)3+3HCl=FeCl3+3H2O。

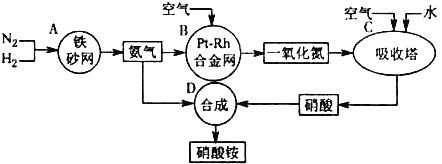
【题目】硫酸性质是中学化学学习的重点。请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称: (写一种)。
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。
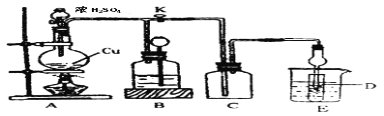
①装置B的作用是贮存多余的气体。B中应放置的液体是_______(填序号)。
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是____ (填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是______ ____。
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为 。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(3)利用FeCl3溶液的氧化性也可以吸收SO2。
①该反应的离子方程式是 。检验FeCl3是否完全被还原的方法为 。
②为验证FeCl3溶液与SO2的反应:同学们将SO2通入0.05 mol·L-1 FeCl3溶液中, 溶液很快由黄色变为红褐色; 将溶液长时间放置后, 最终变为浅绿色。 关于红褐色液体, 以下是同学们的分析推测及实验。
分析推测 | 实验步骤及现象 |
甲: 生成了Fe(OH) 3胶体 乙: 经查阅资料, 可能发生反应: Fe3++6SO2 | ⅰ. 制备Fe(OH) 3胶体并检验 ⅱ. 分别向Fe(OH) 3胶体和该红褐色液体中加入适量铁粉, 振荡后前者不变色, 后者变为浅绿色 |
利用胶体的 (填性质) 可以检验步骤ⅰ中是否得到了Fe(OH) 3胶体。
根据反应b, 说明步骤ⅱ中液体颜色变化的原因是 (用离子方程式结合必要的文字说明) 。
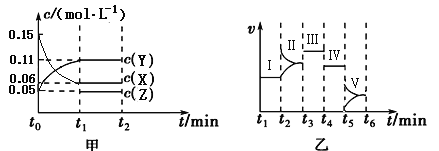
【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。
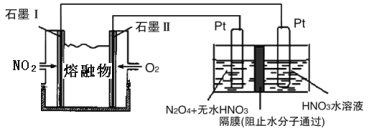
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。