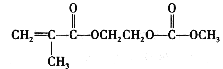题目内容
【题目】一、(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_______________。
(2)稀Na2S溶液有一种腐卵气味,加入AlCl3溶液后,腐卵气味加剧,用离子方程式表示气味加剧过程所发生的化学反应______________。
二、依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:①称量绿矾样品,配成100 mL待测溶液,②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
(1)如何知道滴定到达终点?__________。下列操作会导致测定结果偏低的是_______。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有____________;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
【答案】Cu2+水解产生Cu(OH)2的过程为吸热反应,加热促进水解,故产生浑浊 2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑ 滴入最后一滴KMnO4,溶液恰好由黄绿色变浅紫红色,且半分钟内不变色 C ABD
【解析】
一.(1)根据Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊以及硫酸能和氢氧化铜反应生成硫酸铜和水进行解答;
(2)根据Na2S溶液和AlCl3溶液反应生成氢氧化铝沉淀和硫化氢气体进行解答;
二.(1)高锰酸钾本身呈紫色,无需指示剂,滴定终点时,颜色变成紫红色,并且半分钟内不变色;根据c(待测)=![]() 判断c(待测)的误差;
判断c(待测)的误差;
(2)根据配制100mL待测溶液需要的仪器和滴定所需要的仪器分析判断。
一.(1)因Cu2+水解产生Cu(OH)2,该反应是吸热反应,加热促进水解,故用热水配制时会产生浑浊,故答案为:Cu2+水解产生Cu(OH)2的过程为吸热反应,加热促进水解,故产生浑浊;
(2)铝离子能与硫离子发生双水解反应,生成氢氧化铝和硫化氢,反应的离子方程式为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,故答案为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
二.(1)高锰酸钾本身呈紫色,无需指示剂,当溶液颜色变成紫红色,并且半分钟内不变色,即可说明达到了滴定终点;A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定,标准液浓度减小,所需V(标准)增大,根据c(待测)=![]() 判断可知c(待测)偏大,故A错误;B.锥形瓶用蒸馏水洗涤后未用待测液润洗,所需V(标准)不变,根据c(待测)=
判断可知c(待测)偏大,故A错误;B.锥形瓶用蒸馏水洗涤后未用待测液润洗,所需V(标准)不变,根据c(待测)=![]() 判断可知c(待测)不变,故B错误;C.读取标准液读数时,滴定前平视,滴定到终点后俯视,所需V(标准)偏小,根据c(待测)=
判断可知c(待测)不变,故B错误;C.读取标准液读数时,滴定前平视,滴定到终点后俯视,所需V(标准)偏小,根据c(待测)=![]() 判断可知c(待测)偏小,故C正确;D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失,所需V(标准)偏大,根据c(待测)=
判断可知c(待测)偏小,故C正确;D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失,所需V(标准)偏大,根据c(待测)=![]() 判断可知c(待测)偏大,故D错误;故选C,故答案为:滴入最后一滴KMnO4,溶液恰好由黄绿色变浅紫红色,且半分钟内不变色;C;
判断可知c(待测)偏大,故D错误;故选C,故答案为:滴入最后一滴KMnO4,溶液恰好由黄绿色变浅紫红色,且半分钟内不变色;C;
(2)配制100mL绿矾待测溶液需要的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管;滴定所需要的仪器有:酸式滴定管;锥形瓶;铁架台等,用不到碱式滴定管,故答案为:ABD。

【题目】硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
![]() 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿![]() 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量![]() 、FeO、CaO、
、FeO、CaO、![]() 和
和![]() 等
等![]() 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:

已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的pH | 2.7 | 3.1 |
沉淀完全的pH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
![]() 滤渣1的主要成分为______。
滤渣1的主要成分为______。
![]() “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的![]() 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
【题目】在容积为1 L的密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1<Q2B.N2的转化率:I>Ⅲ
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II