题目内容
18.下列说法正确的是( )| A. | 氯水、氨水和食盐水都能导电,所以Cl2、NH3和NaCl都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向右移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
分析 A、据电解质的概念分析;
B、向醋酸溶液中加入的醋酸溶液浓度比原醋酸溶液浓度大时,原醋酸溶液的电离平衡逆向移动;
C、弱电解质的电离吸热;
D、溶液导电能力的强弱决定于溶液中离子浓度的大小,与电解质的强弱无关.
解答 解:A、电解质是在水溶液或熔融状态下能够电离的化合物,Cl2和NH3都不是电解质,故A错误;
B、向醋酸溶液中加入的醋酸溶液浓度比原醋酸溶液浓度小时,相对于加水稀释,原醋酸溶液的电离平衡正向移动,故B错误;
C、电离吸热,升温能够促进弱电解质的电离,故C正确;
D、溶液导电能力的强弱决定于溶液中离子浓度的大小,与电解质的强弱无关,故D错误;
故选C.
点评 本题考查了电解质的判断、影响弱电解质电离平衡移动的因素、溶液导电能力强弱的影响因素,题目难度不大.

练习册系列答案
相关题目
8.根据S元素的化合价判断,在下列物质中,S元素只有还原性的是( )
| A. | H2S | B. | S | C. | SO2 | D. | H2SO4 |
9.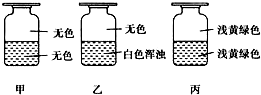 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水.
 向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙注入的液体分别是( )①AgNO3溶液 ②NaOH溶液 ③水.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ①③② |
13.已知0.1mol/L的醋酸溶液存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
3.某有机物是药物生产的中间体,其结构简式如图.下列有关叙述不正确的是( )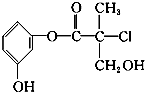

| A. | 该有机物的分子式为C10H11O4Cl | |
| B. | 该有机物与浓溴水可发生取代反应,且与浓硫酸混合共热可发生消去反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| D. | 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
10.下面有关铜的化合物的性质叙述中正确的是( )
| A. | CuSO4变成CuSO4•5H2O是物理变化 | |
| B. | 一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应 | |
| C. | CuO是黑色固体,与水反应可生成Cu(OH)2 | |
| D. | Cu2O遇硝酸可能会被氧化成Cu2+ |
7.有关元素的以下内容,随着原子序数的递增,不呈现周期性变化的是( )
| A. | 化合价 | B. | 原子半径 | C. | 最外层电子排布 | D. | 相对原子质量 |