题目内容
【题目】在一体积固定的密闭容器中,某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表:
实验序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min内,用A表示的该反应的平均速率为________mol·L-1·min-1。
(2)实验2中c2=________,反应经20min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______(填“>”“<”或“=”,下同)v1,且c3_____1.0。
(4)请根据以上实验指出要加快该反应速率可采取的方法:________。(至少列举2种方法)
【答案】0.013 1.0 使用了催化剂 > > 增大反应物A的浓度、升高温度、使用催化剂
【解析】
从反应2A(g)![]() B(g)+D(g)可以看出,反应前后气体的分子数相等,即改变压强平衡不发生移动;从图中数据看,实验1应是参照系。实验2与实验1相比,平衡时A的浓度相同,但达平衡的时间短,由此可推出起始浓度的关系及条件的差异。实验3与实验1相比,10~20分钟内A的浓度变化量大,平衡浓度A也大,由此可推出起始浓度关系。实验4与实验1相比,温度高,达平衡时A的浓度小,由此可推出升高温度对平衡移动的影响。
B(g)+D(g)可以看出,反应前后气体的分子数相等,即改变压强平衡不发生移动;从图中数据看,实验1应是参照系。实验2与实验1相比,平衡时A的浓度相同,但达平衡的时间短,由此可推出起始浓度的关系及条件的差异。实验3与实验1相比,10~20分钟内A的浓度变化量大,平衡浓度A也大,由此可推出起始浓度关系。实验4与实验1相比,温度高,达平衡时A的浓度小,由此可推出升高温度对平衡移动的影响。
(1)实验1中,在10~20min内,c(A)=0.80mol/L-0.67mol/L=0.13mol/L,用A表示的该反应的平均速率为![]() =0.013mol·L-1·min-1。答案为:0.013;
=0.013mol·L-1·min-1。答案为:0.013;
(2)实验2 与实验1 温度相同,则平衡常数相同,平衡时A的浓度相同,则起始浓度相同,实验2中c2=1.0;实验2 达平衡所用时间比实验1 短,则反应速率快,但条件改变没有使平衡发生移动,没有改变平衡浓度,则可推测实验2中还隐含的条件是使用了催化剂。答案为:1.0;使用了催化剂;
(3)设实验3的反应速率为v3,实验1的反应速率为v1,从表中可以看出,10~20分钟内A的浓度变化量大,平衡浓度A也大,则起始浓度也大,反应速率必然快,从而得出v3>v1,且c3>1.0。答案为:>;>;
(4)以上实验,分别从增大浓度、升高温度、使用催化剂进行实验设计,得出条件改变都能加快反应速率的结论,从而得出要加快该反应速率可采取的方法:增大反应物A的浓度、升高温度、使用催化剂。答案为:增大反应物A的浓度、升高温度、使用催化剂。

【题目】关于室温下下列溶液的说法不正确的是( )
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 盐酸 | 醋酸溶液 |
pH | 11 | 11 | 3 | 3 |
A. 水的电离程度:①=②=③=④
B. 分别加水稀释10倍,溶液的pH:①>②>③>④
C. ①③两溶液等体积混合:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. V1 L溶液②与V2 L溶液③混合,若V1∶V2=9∶11,则混合溶液pH=4(忽略溶液体积变化)
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可用NO和Cl2合成。回答下列问题:
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) △H1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H2
③2NO(g)+Cl2(g) 2NOCl(g) △H3
则△H3=_____________(用含△H1、△H2的代数式表示)。
(2)一定温度下,向2L密闭容器中充入amol NOCl(g),发生反应2NOCl(g)2NO(g)+Cl2(g)。
①已知上述反应中正反应速率的表达式为v正=k·cn(NOCl)。300℃时,测得正反应速率与NOCl的浓度的关系如表所示:
c(NOCl)/(mol/L) | v正/(molL-1s-1) |
0.20 | 1.6×10-9 |
0.40 | 6.4×10-9 |
0.60 | 1.44×10-8 |
n=______;k=_____L·mol-1·s-1;当c(NOCl)=0.50 mol·L-1时,v正=_____mol·L-1·s-1。
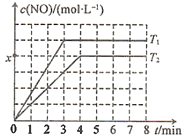
②测得NO的物质的量浓度与温度的关系如图所示(x<0.5a),T1________T2(填“>”“<”或“=”);T2温度下,该反应的平衡常数K=________mol·L-1(用含a、x的代数式表示)。