题目内容
【题目】明矾石的主要成分为K2SO4·A12(SO4)3·2A12O3·6H2O此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下
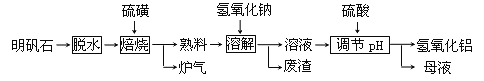
(1)可看成是硫酸铝和单质硫反应,生成氧化铝和一种气体,写该反应的化学方程式为__________________________________________。
(2)分离溶液和废渣的操作需要用到的玻璃仪器有:____________________________________,溶解时反应的离子方程式为________________________________。
(3)“调节pH”后过滤、洗涤A1(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是______________________________________________。
(4)母液中可回收的物质是_____________________________。
(5)若“焙烧”过程中恰好消耗32g硫黄;则理论上最终可得到_____g氢氧化铝。
【答案】 2Al2(SO4)3+3S ![]() 2 Al2O3+9 SO2 ↑ 烧杯,玻璃棒,漏斗 Al2O3+2OH-=2AlO2-+H2O 取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则证明已洗涤干净 K2SO4、Na2SO4 312
2 Al2O3+9 SO2 ↑ 烧杯,玻璃棒,漏斗 Al2O3+2OH-=2AlO2-+H2O 取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则证明已洗涤干净 K2SO4、Na2SO4 312
【解析】根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1) 根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2 Al2O3+9 SO2 ↑ ;(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用;(5)2Al2(SO4)3+3S
2 Al2O3+9 SO2 ↑ ;(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用;(5)2Al2(SO4)3+3S ![]() 2 Al2O3+9 SO2 ↑ 依据铝元素守恒计算,若“焙烧”过程中恰好消耗48g硫黄物质的量=32g/32g·mol-1=1.0mol,反应的Al2(SO4)3物质的量为2/3 mol,K2SO4·Al2(SO4)3·2Al2O3·6H2O物质的量为2/3 mol,
2 Al2O3+9 SO2 ↑ 依据铝元素守恒计算,若“焙烧”过程中恰好消耗48g硫黄物质的量=32g/32g·mol-1=1.0mol,反应的Al2(SO4)3物质的量为2/3 mol,K2SO4·Al2(SO4)3·2Al2O3·6H2O物质的量为2/3 mol,
K2SO4·Al2(SO4)3·2Al2O3·6H2O~6Al(OH)3,
1 6×78
2/3mol m
则理论上最终可得到m=312g.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案【题目】能源是人类生存与发展必不可缺的物质,对传统能源进行脱硫、脱硝处理,能提高能源在能源消费中的比例是改变目前我国频发的雾霾天气的有效措施。
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有10e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式__________________。
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g) △H=十8.0 kJ·mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
③2CO(g)+O2 (g) =2CO2 (g) △H= -566.0 kJ·mol-1
④2H2 (g)+O2 (g) =2H2O(g) △H =-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为__________________。
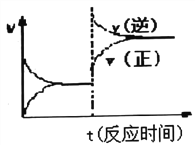
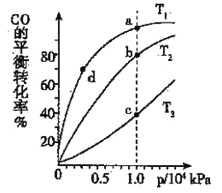
(3)煤炭液化也有助于减少雾霾天气的发生,液化反应之一为:CO(g)+2H2(g)![]() CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:2CO(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
容器 | c(CO) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)与v(逆)大小比较 |
I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)= v(逆) |
II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v(正)____v(逆)(填“>” |
填写表中空白处,并写出其推测过程___________。
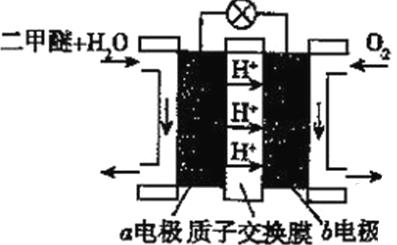
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图所示,a、b均为惰性电极,a极的电极反应式为________________________;当消耗1molO2时,通过质子交换膜的质子数为_________NA;若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为________(燃烧电池的工作效率是指电池所能产生的最大电能与燃料燃烧时所能释放的全部热能之比)。