题目内容
【题目】将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:
(1)原混合物中Na2O的质量为________ g。
(2)所得溶液的物质的量浓度为________ mol·L-1。
【答案】6.21
【解析】
2Na2O2+2H2O===4NaOH+O2↑
2 mol 22.4 L
n(Na2O2) 1.12 L
n(Na2O2)=(2 mol×1.12 L)/22.4 L=0.1 mol
m(Na2O2)=0.1 mol×78 g·mol-1=7.8 g
m(Na2O)=14 g-7.8 g=6.2 g
n(Na2O)=![]() =0.1 mol
=0.1 mol
根据题意有Na2O2~2NaOH;Na2O~2NaOH
n(NaOH)=2×(0.1 mol+0.1 mol)=0.4 mol
c(NaOH)=![]() =1 mol·L-1。
=1 mol·L-1。

【题目】从下表的阴、阳离子中选出适当的离子组成三种电解质(每种离子只能选用一次),用惰性电极对每种电解质溶液进行电解。回答下列问题:
阳离子 | H+、Na+、Ag+ |
阴离子 | Cl-、SO42-、NO3- |
(1)若阴极放出氢气,阳极放出氧气,且电解后溶液的pH变小,则所选用的电解质的化学式是___________,阴极的电极反应式为___________。
(2)若阴极析出金属,阳极放出氧气,则所选用的电解质的化学式是___________,阳极的电极反应式为_______________________________________________________________。
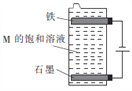
(3)用如图所示装置电解第三种电解质M的饱和溶液,写出该电解池中发生反应的总化学方程式:____________________________。