题目内容
【题目】已知:①4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
②N2(g)+O2(g) ![]() 2NO(g) △H2
2NO(g) △H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下
③NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
下列说法不正确的是
A. 反应③一定能自发进行
B. 反应②生成物总能量高于反应物总能量
C. 反应①使用催化剂,反应速率加快,△H1减小
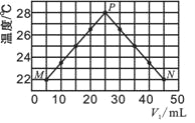
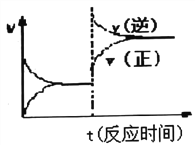
D. 反应③达到平衡后改变条件,v(正)、v(逆)的变化如图所示,则该条件可能是升高温度
【答案】C
【解析】A、化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T·△S<0时,反应能自发进行,故A正确;B、①4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1,③NH3(g)+4NO(g)+O2(g)
4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1,③NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1,(①-③)/4得N2(g)+O2(g)
4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1,(①-③)/4得N2(g)+O2(g)![]() 2NO(g)△H2=180kJ·molˉ1,△H>0故此反应为吸热反应,故生成物总能量高于反应物总能量,故B正确;C、反应①使用催化剂,反应速率加快,△H1不变,故C错误;D、升高温度,向吸热方向进行,则向逆反应方向进行,即V逆>V正,与图象不符,故D正确;故选C。
2NO(g)△H2=180kJ·molˉ1,△H>0故此反应为吸热反应,故生成物总能量高于反应物总能量,故B正确;C、反应①使用催化剂,反应速率加快,△H1不变,故C错误;D、升高温度,向吸热方向进行,则向逆反应方向进行,即V逆>V正,与图象不符,故D正确;故选C。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目