��Ŀ����
����Ŀ����Դ�����������뷢չ�ز���ȱ�����ʣ��Դ�ͳ��Դ�������������������������Դ����Դ�����еı����Ǹı�Ŀǰ�ҹ�Ƶ����������������Ч��ʩ��
��1����(N2H4)�ͻ��������һ����Ҫ�Ļ���ƽ������������·��Ӿ�����ͬ�ĵ����������߷�Ӧ������������10e-���ӣ���һ��������Ϊ���ȶ��ĵ��ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ__________________��
��2����ȼú������β�����л��մ����������ڿ��������ĸ��ƣ����ܱ��Ϊ����β�������������漰������Ҫ��Ӧ���£�
��2CO(g)+SO2(g)=S(g)+2CO2(g) ��H=ʮ8.0 kJ��mol��1
��2H2 (g)+SO2(g)=S(g)��2H2O(g) ��H=��90.4 kJ��mol��1
��2CO(g)+O2 (g) =2CO2 (g) ��H= -566.0 kJ��mol��1
��2H2 (g)+O2 (g) =2H2O(g) ��H =��483.6 kJ��mol��1
S(g)��O2(g)��Ӧ����SO2(g)���Ȼ�ѧ����ʽΪ__________________��
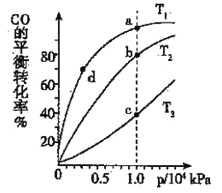
��3��ú̿Һ��Ҳ�����ڼ������������ķ�����Һ����Ӧ֮һΪ��CO(g)+2H2(g)![]() CH3OH(g)������Ӧ���ȣ���������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ��������Ӧ���ʣ�v(a)��v(b)��v(c)��v(d)��С�����˳��Ϊ__________��ʵ����������������T 1��C��1��106Pa���ң�ѡ���ѹǿ��������________��
CH3OH(g)������Ӧ���ȣ���������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ��������Ӧ���ʣ�v(a)��v(b)��v(c)��v(d)��С�����˳��Ϊ__________��ʵ����������������T 1��C��1��106Pa���ң�ѡ���ѹǿ��������________��
��4����ҵ����������Դ������(CH3OCH3)��ԭ��֮һΪ��2CO(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)����ͬ�¶��£������������н���������Ӧ��ijʱ���������и���̬���ʵ�Ũ��(mol/L)�����淴Ӧ����֮��Ĺ�ϵ���±���ʾ��
CH3OCH3(g)+3H2O(g)����ͬ�¶��£������������н���������Ӧ��ijʱ���������и���̬���ʵ�Ũ��(mol/L)�����淴Ӧ����֮��Ĺ�ϵ���±���ʾ��
���� | c(CO) | c(H2) | c(CH3OCH3) | c(H2O) | v(��)��v(��)��С�Ƚ� |
I | 1.0��10-2 | 1.0��10-2 | 1.0��10-4 | 1.0��10-4 | v(��)= v(��) |
II | 2.0��10-2 | 1.0��10-2 | 1.0��10-4 | 2.0��10-4 | v(��)____v(��)(�>�� |
��д���пհ״�����д�����Ʋ����___________��
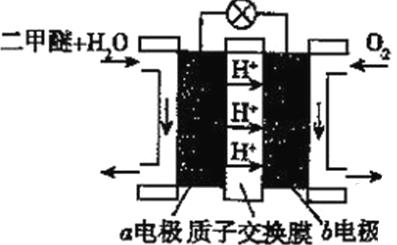
��5��������(ȼ����Ϊ1455kJ/mol)ȼ�ϵ����һ����ɫ��أ��乤��ԭ����ͼ��ʾ��a��b��Ϊ���Ե缫��a���ĵ缫��ӦʽΪ________________________��������1molO2ʱ��ͨ�����ӽ���Ĥ��������Ϊ_________NA������ع���ʱ����1mol���������ܲ�����������Ϊ1320kJ�����ȼ�ϵ�صĹ���Ч��Ϊ________(ȼ�յ�صĹ���Ч����ָ������ܲ�������������ȼ��ȼ��ʱ�����ͷŵ�ȫ������֮��)��
���𰸡� N2H4��2H2O2=4H2O��N2 S(g)��O2(g)=SO2(g) ��H=��574.0kJ��mol��1 v(d)<v(a)<v(b)<v(c) ѹǿΪ1��104kPaʱ��CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӣ��ò���ʧ < ��I�����K=1��Q=2.0>K����Ӧ������� CH3OCH3��3H2O��12e��=2CO2��12H�� 4 90.7%
����������1���������·��Ӿ�����ͬ�ĵ���������18 e-�����߷�Ӧ������������10e-���ӣ���һ��������Ϊ���ȶ��ĵ��ʣ��ۺ�������Ϣ�������жϼ�ΪH2O2��������Ϊˮ�͵������÷�Ӧ�Ļ�ѧ����ʽΪN2H4��2H2O2=4H2O��N2 ��
��2����������֪���Ȼ�ѧ����ʽ��-���ɵ�S(g)��O2(g)=SO2(g)�� ������H= -566.0 kJ��mol��1 -8.0 kJ��mol��1=��574.0kJ��mol��1���� S(g)��O2(g)��Ӧ����SO2(g)���Ȼ�ѧ����ʽΪS(g)��O2(g)=SO2(g) ��H=��574.0kJ��mol��1��
��3����ΪCO(g)+2H2(g)![]() CH3OH(g)����Ӧ�Ƿ��ȷ�Ӧ������CO��ƽ��ת�������¶����߶���С����ͼ��֪������ͬѹǿ�£���ͬ�¶ȵ�CO��ƽ��ת���ʴ�С�����˳��Ϊ
CH3OH(g)����Ӧ�Ƿ��ȷ�Ӧ������CO��ƽ��ת�������¶����߶���С����ͼ��֪������ͬѹǿ�£���ͬ�¶ȵ�CO��ƽ��ת���ʴ�С�����˳��Ϊ![]() T3<
T3< ![]() T2<
T2< ![]() T1�������¶��ɸߵ��͵�˳��ΪT3>T2>T1����Ϊ�¶�Խ��ѧ��Ӧ����Խ�졢ѹǿԽ��ѧ��Ӧ����Խ�죬��������Ӧ����v(a)��v(b)��v(c)��v(d)��С�����˳��Ϊv(d)<v(a)<v(b)<v(c)��ʵ����������������T 1��C��1��106Pa���ң�ѡ���ѹǿ��������ѹǿΪ1��104kPaʱ��CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӣ��ò���ʧ��
T1�������¶��ɸߵ��͵�˳��ΪT3>T2>T1����Ϊ�¶�Խ��ѧ��Ӧ����Խ�졢ѹǿԽ��ѧ��Ӧ����Խ�죬��������Ӧ����v(a)��v(b)��v(c)��v(d)��С�����˳��Ϊv(d)<v(a)<v(b)<v(c)��ʵ����������������T 1��C��1��106Pa���ң�ѡ���ѹǿ��������ѹǿΪ1��104kPaʱ��CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӣ��ò���ʧ��
��4��������I�����ݿ�֪��v(��)= v(��)˵����Ӧ�Ѵﻯѧƽ��״̬������ K=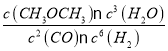 =1������ͬ�¶��£�����II��Qc=2.0>K����Ӧ�������淴Ӧ������У�����v(��) <v(��)��
=1������ͬ�¶��£�����II��Qc=2.0>K����Ӧ�������淴Ӧ������У�����v(��) <v(��)��
��5���ɶ�����ȼ�ϵ�ع���ԭ��ʾ��ͼ��֪��a��b�ֱ�Ϊ������������a���ĵ缫��ӦʽΪCH3OCH3��3H2O��12e��=2CO2��12H����������1molO2ʱ��������Ԫ�صĻ��ϼ۱仯�����жϣ�ͨ�����ӽ���Ĥ�����ӵ����ʵ���Ϊ4mol������ͨ�����ӽ���Ĥ��������Ϊ4NA������ع���ʱ����1mol���������ܲ�����������Ϊ1320kJ���ɶ����ѵ�ȼ����Ϊ1455kJ/mol���Լ������ȼ�ϵ�صĹ���Ч��Ϊ![]() 90.7% ��
90.7% ��

 ��У����ϵ�д�
��У����ϵ�д�