题目内容
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )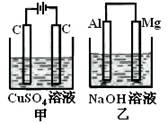
| A.相同条件下产生气体的体积:V甲=V乙 |
| B.溶液pH值变化:甲减小乙增大 |
| C.溶液的质量变化:甲减小乙增大 |
| D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:Mg - 2e—= Mg2+ |
C
解析试题分析:甲是电解池,乙是原电池。对于甲,在阳极发生反应4OH—-4e-= O2↑+2H2O当电路中通过的电子是0.1mol时,产生气体0.025mol.对于乙:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若转移电子0.1mol,则产生气体的物质的量为0.05mol,因此相同条件下产生气体的体积V甲<V乙。错误。B.对于甲,反应的总方程式为:2CuSO4+2H2O 2Cu+ O2↑+2H2SO4,随着电解的进行,溶液的酸性增强,所以溶液pH值减小;对于乙,反应的总方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑随着电解的进行,溶液的碱性减弱,所以溶液pH值减小。错误。C.根据电解的总方程式可知:两个装置中溶液的质量变化:甲减小乙增大。正确。D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:2Al - 6e—+8OH-= 2AlO2-++3H2↑+4H2O。错误。
2Cu+ O2↑+2H2SO4,随着电解的进行,溶液的酸性增强,所以溶液pH值减小;对于乙,反应的总方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑随着电解的进行,溶液的碱性减弱,所以溶液pH值减小。错误。C.根据电解的总方程式可知:两个装置中溶液的质量变化:甲减小乙增大。正确。D.电极反应式:甲中阴极:Cu2++2e—= Cu, 乙中负极:2Al - 6e—+8OH-= 2AlO2-++3H2↑+4H2O。错误。
考点:考查原电池、电解池的反应原理及应用的知识。

据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是
| A.电池放电时Na+从a极区移向b极区 |
| B.每消耗6molH2O2转移电子6mol |
| C.电极a采用MnO2,MnO2既作电极又有催化作用 |
| D.该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+ |
银锌纽扣电池的总反应式为Zn+Ag2O+H2O = Zn(OH)2+2Ag,下列说法不正确的是( )
| A.锌做负极 | B.放电时,正极产物是银 |
| C.电解质溶液不可能呈酸性 | D.充电时发生了原电池反应 |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是( )
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2+4e—+2H2O=4OH— |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O |
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
| A.电池工作时H+ 移向负极 |
| B.该电池用的电解质溶液是KOH溶液 |
| C.甲电极反应式为:CO(NH2 )2 +H2O - 6e-= CO2 +N 2 + 6H+ |
| D.电池工作时,理论每有净化1mol CO(NH2 )2,消耗 33.6 L O2 |
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(Na+)=0.2 mol·L-1 |
| B.电解后溶液中c(H+)=0.2 mol·L-1 |
| C.上述电解过程中共转移0.4 mol电子 |
| D.电解后得到的Cu的物质的量为0.1 mol |
下列有关说法正确的是
A.氨水稀释后,溶液中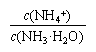 的值减小 的值减小 |
| B.0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH>0 |
