题目内容
【题目】含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(2)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。
【答案】c(N2O) c2(H2O) 4NA 2.35![]() 10-3mol·L-1·s-1 1.87
10-3mol·L-1·s-1 1.87![]() 10-3mol·L-1·s-1 随着反应的进行,反应物浓度减小,反应速率减慢 6.0(或5.99) 增大OH-的浓度(或移去产物等其他合理答案)
10-3mol·L-1·s-1 随着反应的进行,反应物浓度减小,反应速率减慢 6.0(或5.99) 增大OH-的浓度(或移去产物等其他合理答案)
【解析】
(1)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,依据氧化还原反应得失电子守恒计算转移电子数;
(2)①根据转化率计算浓度的变化,结合v=![]() 计算反应速率,结合浓度对反应速率的影响分析;
计算反应速率,结合浓度对反应速率的影响分析;
②360s时,转化率不再发生改变,可说明达到平衡状态,以此可计算平衡常数;
③为提高O2NC6H4COOC2H5的平衡转化率,可使平衡向正向移动,除温度外,还可增加另一种反应物浓度或减小生成物的浓度(或移去产物)。
(1)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3(s)![]() N2O(g)+2H2O(g),250℃时,水为气体状态,故平衡常数K=c(N2O)c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4NA;
N2O(g)+2H2O(g),250℃时,水为气体状态,故平衡常数K=c(N2O)c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4NA;
(2)①在60~90s内的平均反应速率v=![]() =2.35
=2.35![]() 10-3 mol·L-1·s-1,在90~120s内的平均反应速率v=
10-3 mol·L-1·s-1,在90~120s内的平均反应速率v=![]() =1.87
=1.87![]() 10-3mol·L-1·s-1,由此可得出的结论是随着反应的进行,反应物浓度减小导致反应速率降低;
10-3mol·L-1·s-1,由此可得出的结论是随着反应的进行,反应物浓度减小导致反应速率降低;
②反应时间达到360s时,硝基苯甲酸乙酯的转化率不再随时间的变化而发生变化,即反应在360s时达到平衡。此时体系内两种产物浓度为0.80 mol/L×71%,反应物浓度为0.80mol/L×29%,平衡常数K=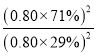 =6.0;
=6.0;
③根据可逆反应的特点可知增加OH-的浓度、及时地移去产物均可以增大硝基苯甲酸乙酯的转化率。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:

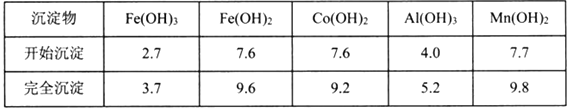
已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。