��Ŀ����
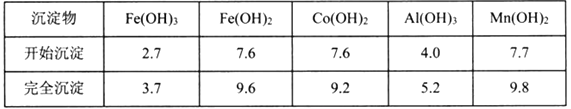
����Ŀ��CoCl2��6H2O��һ������Ӫ��ǿ������һ������ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��Co(OH)3����������Fe2O3��Al2O3��MnO��)��ȡCoCl2��6H2O�Ĺ����������£�
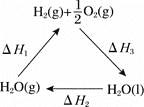
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
�����������£�ClO3����������Co2+��ClO3��ת��ΪCl����
�۲���������������������ʽ����ʱ��Һ��pH���±���(��������Ũ��Ϊ��0.01mol/L)
��CoCl2��6H2O�۵�Ϊ86�棬������110~120��ʱ��ʧȥ�ᾧ������ˮ�Ȼ��ܡ�
��ش�
��1������Na2CO3��pH��5.2�����������õ��ij������ɷ�Ϊ___________��
��2����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ����ȡ��ʹ�õ�����pH��Χ��___________��(��ѡ�������ĸ)
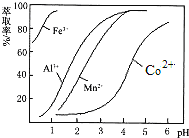
A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
��3��Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡ2g�Ĵֲ�Ʒ����ˮ�����100mL��Һ��ȡ��20mL������ƿ������K2CrO4��ָʾ��( Ag2CrO4Ϊש��ɫ����)����0.2mol/L��AgNO3��Һ�ζ����յ㣬�ظ�2-3�Σ�ƽ������AgNO3����Һ10.00mL���ôֲ�Ʒ��CoCl2��6H2O����������Ϊ___________����K2CrO4��ָʾ��ʱ����Ҫ������ҺpHֵΪ6.5~10.5���Է���ԭ��______________________��
���𰸡�Fe(OH)3, Al(OH)3 B 59.5% pH̫СK2CrO4����Cl-(��ת��ΪCr2O72-)�� pH̫������Ag(OH)���� (��Ag2O����)
��������
���ܷ����м���������������ƣ��ɵ�CoCl2��AlCl3��FeCl2��MgCl2��CaCl2��MnCl2������NaClO3���ɵõ�FeCl3��Ȼ�����Na2CO3��pH��5.2���ɵõ�Fe(OH)3��Al(OH)3���������˺�������Һ��Ҫ����CoCl2��MgCl2��CaCl2��MnCl2������Һ�м���NaF��Һ����ȥ��þ���ӣ�Ȼ����˵õ�����Һ��II�м�����ȡ�����õ��Ȼ��ܡ�
(1)���������ӡ�����������̼������ӷ���˫ˮ�����ɳ����Ͷ�����̼���н��
(2)��Һ���м�����ȡ���������dz�ȥ�����ӣ�����ͼʾѡ����ʵ�pH��Χ��
(3)����CoCl2��6H2O��AgNO3�����ʵ�����ϵ��������ȥ�����������ʵ��������CoCl2��6H2O�����������ô����ʵ�����������Ʒ�������õ�����������
(1)NaClO3�������ǽ�Fe2+������Fe3+����Na2CO3��pH��5.2����������̼������ӷ���˫ˮ���������������Ͷ�����̼��ˮ������ӷ���ʽΪ��2Al3++3CO32-+3H2O=2Al(OH)3��+3CO2��������������̼������ӷ���˫ˮ���������������Ͷ�����̼��ˮ������ӷ���ʽΪ��2Fe3++3CO32-+3H2O=2Fe(OH)3��+3CO2�������Գ���X�ijɷ�Ϊ��Fe(OH)3��Al(OH)3��
(2)��������ͼ��֪����ʱ��Һ�д���Mn2+��Co2+�������ӣ�����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��֪��������ҺpH��2.5��3.5֮�䣬��ʹMn2+��ȫ����������ֹCo2+ת��ΪCo(OH)2��������ѡB��
(3) �贿CoCl2��6H2O������Ϊx��1mol����������1mol�����ӣ���1molCoCl2��6H2O����2AgNO3������CoCl2��6H2O�������������ʵ�����ϵ��

![]() ����ã�x=0.238g��ԭ����Һ100ml������õ��Ȼ��ܵ�����Ϊ20ml��Һ�壬��Ҫ��20ml����Һ�����100ml��Һ��CoCl2��6H2O�Ĵ���Ϊ
����ã�x=0.238g��ԭ����Һ100ml������õ��Ȼ��ܵ�����Ϊ20ml��Һ�壬��Ҫ��20ml����Һ�����100ml��Һ��CoCl2��6H2O�Ĵ���Ϊ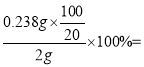 59.5% ��pH̫СK2CrO4����Cl-(��ת��ΪCr2O72-)�� pH̫������AgOH������������Ҫ������ҺpHֵΪ6.5��10.5��
59.5% ��pH̫СK2CrO4����Cl-(��ת��ΪCr2O72-)�� pH̫������AgOH������������Ҫ������ҺpHֵΪ6.5��10.5��

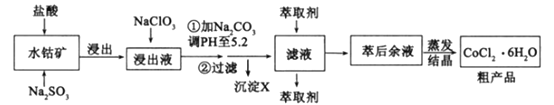
����Ŀ��һ���¶��£������������ͬ�ĺ����ܱ������з�����Ӧ��C(s)��H2O(g)![]() CO(g)��H2(g)
CO(g)��H2(g)
���� ��� | �¶�(��) | ��ʼ���ʵ���(mol) | ƽ�����ʵ���(mol) | |||
C(s) | H2O(g) | CO(g) | H2(g) | CO(g) | ||
�� | 500 | 1.0 | 1.0 | 0 | 0 | 0.4 |
�� | 500 | 0 | 0 | 2.0 | 2.0 | |
�� | 400 | 1.0 | 1.0 | 0 | 0 | 0.3 |
����˵����ȷ����
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ�������ڵ�ѹǿ��2P����P��
C.�ﵽƽ��ʱ����Ӧ���ת��������(H2O)������(CO)��1
D.����ʼʱ���������м���2.7 mol C(s)��0.4mol H2O(g)��0.6mol CO(g)��0.6mol H2(g)����Ӧ�����淴Ӧ�������
����Ŀ�������������ڻ�ѧ��ҵ��������Ҫ��Ӧ�ã��ش��������⣺
��1��һ�������£�����識��ȷֽ�õ��IJ���ֻ��N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ��ƽ�ⳣ������ʽΪK=___________������1mol�������ȫ�ֽ⣬��ת�Ƶ��ӵ���ĿΪ___________(��NAΪ�����ӵ�������ֵ)��
��2�����������������ڼ��������·�����Ӧ��O2NC6H4COOC2H5+OH��![]() O2NC6H4COO��+C2H5OH�����ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.80mol��L��1��T��ʱ���O2NC6H4COOC2H5��ת��������ʱ��仯�����������ʾ��
O2NC6H4COO��+C2H5OH�����ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.80mol��L��1��T��ʱ���O2NC6H4COOC2H5��ת��������ʱ��仯�����������ʾ��
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
�ٸ÷�Ӧ��60~90s��90~120s�ڵ�ƽ����Ӧ���ʷֱ�ԼΪ___________��___________���Ƚ����ߴ�С�ɵó��Ľ�����______________________��
�ڼ���T��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ______________________��
��Ϊ���O2NC6H4COOC2H5��ƽ��ת���ʣ������ʵ����Ʒ�Ӧ�¶��⣬�����Բ�ȡ�Ĵ�ʩΪ______________________(д��һ������)��