题目内容
18.A元素的最高正价和最低负价的绝对值之差为6,B元素和A元素的原子次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是( )| A. | MgF2 | B. | CaCl2 | C. | K2S | D. | Na2O |
分析 B元素的最高正价和最低负价的绝对值之差为6,可知最高价为+7价,最低价为-1价,则为ⅦA族元素,因A元素和B元素原子的次外层都有8个电子,可知B为Cl元素,AB2在水溶液中电离出电子层结构相同的离子,可知A最外层由2个电子,化合价为+2价,应为Ca元素,以此解答该题.
解答 解:B元素的最高正价和最低负价的绝对值之差为6,可知最高价为+7价,最低价为-1价,则为ⅦA族元素,
因A元素和B元素原子的次外层都有8个电子,可知B为Cl元素,
AB2在水溶液中电离出电子层结构相同的离子,可知A最外层由2个电子,化合价为+2价,核外各层电子数目分别为2、8、8、2,应为Ca元素,
则AB2是CaCl2,
故选:B.
点评 本题考查原子结构与元素的性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握原子结构特点,从元素化合价的角度判断元素的种类,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
8.NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
9.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )
| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
6.同族元素所形成的同类型的化合物,其结构和性质往往相似.化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
3.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 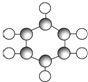 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
10. 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
7.为把溴水中溴单质萃取出来,下列物质可达到目的是( )
| A. | 乙醇 | B. | 苯酚溶液 | C. | 直馏汽油 | D. | 乙酸 |
8.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙烷和苯 | C. | 乙烯和乙炔 | D. | 甲烷和丙烷 |
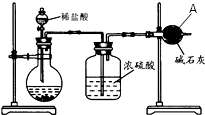 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)