题目内容
11. (Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.写出乙醇燃烧的化学方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.
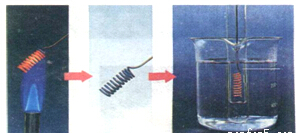
(Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.写出乙醇燃烧的化学方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.(Ⅱ)乙醇的催化氧化反应在有机合成工业有着广泛的用途.某同学用如图所示的方法进行乙醇的催化氧化实验:向试管中加入3-4mL无水乙醇,浸入50℃左右的热水中,将铜丝烧热,迅速插入乙醇中,反复多次.
(1)在上述实验过程中,铜丝绕成螺旋状的作用是增大了铜丝的接触面积,加快反应速率
(2)铜丝的颜色先后发生的变化是铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色,请写出反应的化学方程2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
分析 (Ⅰ)乙醇为清洁能源,可燃烧生成二氧化碳和水;
(Ⅱ)(1)增大了铜丝的接触面积,加快反应速率;
(2)铜在空气中燃烧,由红色变为黑色,插入乙醇中时由黑色变为红色.
解答 解:(Ⅰ)乙醇燃烧生成二氧化碳和水,燃烧的化学方程式是C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O,
故答案为:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O;
(Ⅱ)(1)铜丝绕成螺旋状的作用是:增大了铜丝的接触面积,加快反应速率
故答案为:增大了铜丝的接触面积,加快反应速率;
(2)铜丝的颜色先后发生的变化是:铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色;反应方程式是:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O;
故答案为:铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的双基的考查,注意把握乙醇催化氧化的特点以及相关方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4. (1)25℃时,下列4种溶液.请回答下列问题.
(1)25℃时,下列4种溶液.请回答下列问题.
A.0.01 mol•L-1 氨水 B.0.01mol•L-1 NaOH 溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
①上述4种溶液中,水的电离程度最大的是A(填序号);
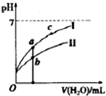
②若将C、D溶液分別稀释10倍,pH变化如图,判断曲线I对应的溶液为D(填序号),图中a、b、c三点对应溶液的导电能力由强到弱的顺序是b>a>c.(用a、b、c 表示)
③若将B、C溶液等体积混合,所得溶液的pH<7(填“>”、“<”或“=”).
(2)已知25℃:
①一元酸H3PO2:的电离方程式为H3PO2?H2PO2-+H+;
②H2S溶液与NaA溶液反应的化学方程式为H2S+NaA=NaHS+HA;
③经测定,25℃时,0.01 mol•L-1 Na2S溶液的PH为11,则:
c(H+)+c(HS-)+2c(H2S)=1.0×10-3mol/L.
 (1)25℃时,下列4种溶液.请回答下列问题.
(1)25℃时,下列4种溶液.请回答下列问题.A.0.01 mol•L-1 氨水 B.0.01mol•L-1 NaOH 溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
①上述4种溶液中,水的电离程度最大的是A(填序号);
②若将C、D溶液分別稀释10倍,pH变化如图,判断曲线I对应的溶液为D(填序号),图中a、b、c三点对应溶液的导电能力由强到弱的顺序是b>a>c.(用a、b、c 表示)
③若将B、C溶液等体积混合,所得溶液的pH<7(填“>”、“<”或“=”).
(2)已知25℃:
| 物质 | H3PO2 | H2S | 一元酸HA |
| Kn | Kn=5.9×l0-2 | Kn1=9.1×l0-8 Kn2=l.l×l0-12 | Kn=l.1×1O-10 |
②H2S溶液与NaA溶液反应的化学方程式为H2S+NaA=NaHS+HA;
③经测定,25℃时,0.01 mol•L-1 Na2S溶液的PH为11,则:
c(H+)+c(HS-)+2c(H2S)=1.0×10-3mol/L.
2.某主族元素的最高价含氧酸的阴离子的符号是RO3-,则该元素的气态氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
19.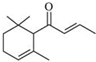 一种从植物中提取的天然化合物α-damascone可用于制作“香水”,其结构为:,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物α-damascone可用于制作“香水”,其结构为:,有关该化合物的下列说法不正确的是( )
 一种从植物中提取的天然化合物α-damascone可用于制作“香水”,其结构为:,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物α-damascone可用于制作“香水”,其结构为:,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验 | |
| D. | 1 mol该化合物完全燃烧消耗19 molO2 |
16.实验室进行下列实验:其中需用水浴加热的有( )
①苯与浓HNO3在浓H2SO4作用下制硝基苯;
②酚醛树脂的制备;
③葡萄糖溶液的银镜反应;
④乙酸与乙醇在浓硫酸作用下制乙酸乙酯.
①苯与浓HNO3在浓H2SO4作用下制硝基苯;
②酚醛树脂的制备;
③葡萄糖溶液的银镜反应;
④乙酸与乙醇在浓硫酸作用下制乙酸乙酯.
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
1.硫酸铵分解的化学方程式为 3(NH4)2SO4═4NH3↑+3X↑+N2↑+6H2O,则X的化学式为( )
| A. | S | B. | O2 | C. | SO2 | D. | SO3 |
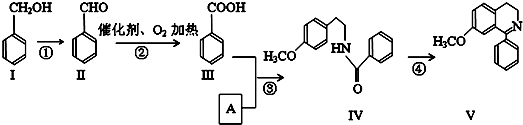
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2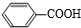 .
.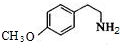 .
. .
.