题目内容
【题目】按要求分别用双线桥或单线桥标出下列反应中电子转移的情况。
①2Na+Cl2![]() 2NaCl(双线桥)____________。
2NaCl(双线桥)____________。
②MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O(双线桥)__________。
MnCl2+Cl2↑+2H2O(双线桥)__________。
③Fe+CuSO4=Cu+FeSO4(单线桥)___________
【答案】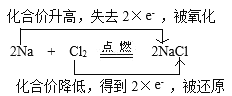

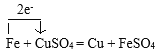
【解析】
在用双线桥法表示时,根据在反应中,元素化合价升高,失去电子,被氧化;元素化合价降低,获得电子,被还原,在桥上注明元素化合价的升降、电子的得失及反应类型;
在单线桥法表示时,箭头从反应物中失去电子的元素指向反应物中获得电子的元素,桥上只注明电子转移数目。
①在2Na+Cl2![]() 2NaCl反应中,Cl元素化合价由反应前Cl2单质的0价变为反应后NaCl的-1价,化合价降低,获得2×1e-电子,被还原;Na元素化合价由反应前Na单质的0价变为反应后NaCl的+1价,化合价升高,失去2×1e-电子,被氧化,用双线桥法表示为:
2NaCl反应中,Cl元素化合价由反应前Cl2单质的0价变为反应后NaCl的-1价,化合价降低,获得2×1e-电子,被还原;Na元素化合价由反应前Na单质的0价变为反应后NaCl的+1价,化合价升高,失去2×1e-电子,被氧化,用双线桥法表示为: ;
;
②在MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应中,Cl元素化合价由反应前HCl中的-1价变为反应后Cl2的0价,化合价升高,失去2×1e-电子,被氧化;Mn元素化合价由反应前MnO2中的+4价变为反应后MnCl2的+2价,化合价降低,获得2×1e-电子,被还原,用双线桥法表示为:
MnCl2+Cl2↑+2H2O反应中,Cl元素化合价由反应前HCl中的-1价变为反应后Cl2的0价,化合价升高,失去2×1e-电子,被氧化;Mn元素化合价由反应前MnO2中的+4价变为反应后MnCl2的+2价,化合价降低,获得2×1e-电子,被还原,用双线桥法表示为: ;
;
③在Fe+CuSO4=Cu+FeSO4反应中,Fe元素化合价由反应前Fe单质的0价变为反应后FeSO4中的+2价,化合价升高,失去2e-电子,被氧化;Cu元素化合价由反应前CuSO4中的+2价变为反应后Cu单质的0价,化合价降低,获得2e-电子,被还原,用单线桥法表示为: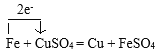 。
。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的物质的量比为1∶3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=k正/k逆成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时v正>v逆








