题目内容
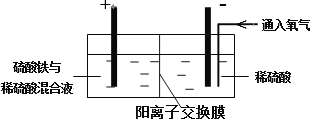
【题目】某锂离子电池工作原理如下图所示,电池反应为:Li1-xCoO2+LixC![]() LiCoO2+C。下列说法不正确的是
LiCoO2+C。下列说法不正确的是

A. 放电时,电子从b极经用电器流向a极
B. 放电时,若转移1mol e-,碳材料将增重7 g
C. 充电时,锂离子通过隔膜进入右室
D. 充电时,a极反应:LiCoO2-xe-= Li1-xCoO2+xLi+
【答案】B
【解析】电池反应为:Li1-xCoO2+LixC![]() LiCoO2+C。放电时,a极反应: Li1-xCoO2+xLi++xe-= LiCoO2,故为原电池的正极,b极为负极,电极反应:LixC-xe-= xLi++C,A. 放电时,电子从负极b极经用电器流向正极a极,选项A正确;B. 根据电极反应:LixC-xe-= xLi++C,放电时,若转移1mol e-,碳材料将增重
LiCoO2+C。放电时,a极反应: Li1-xCoO2+xLi++xe-= LiCoO2,故为原电池的正极,b极为负极,电极反应:LixC-xe-= xLi++C,A. 放电时,电子从负极b极经用电器流向正极a极,选项A正确;B. 根据电极反应:LixC-xe-= xLi++C,放电时,若转移1mol e-,碳材料将增重![]() g,选项B不正确;C. 充电时,锂离子通过隔膜向阴极室进入右室,选项C正确;D. 充电时,a极为阳极,电极反应:LiCoO2-xe-= Li1-xCoO2+xLi+,选项D正确。答案选B。
g,选项B不正确;C. 充电时,锂离子通过隔膜向阴极室进入右室,选项C正确;D. 充电时,a极为阳极,电极反应:LiCoO2-xe-= Li1-xCoO2+xLi+,选项D正确。答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
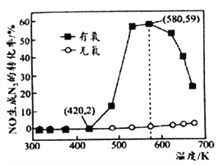
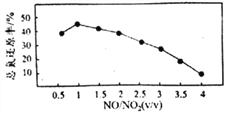
小学生10分钟应用题系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)用消石灰和氯化铵固体制备NH3

①NH3的发生装置应选择上图中的_______(填序号),制备NH3的化学方程式为______。
②欲收集一瓶干燥的NH3,选择上图中的装置,其连接顺序为:发生装置→_________(按气流方向,用小写字母表示)。
(2)研究NH3与NO2的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__________ | ②反应的化学方程式 _______________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | 溶液倒吸入Y管 | ③________________ |