题目内容
20.合成氨工艺的一个重要工序是铜洗,其目的是用铜液吸收在生产过程中产生的CO和CO2等气体.铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3?Ac 其中Ac-表示醋酸根离子CH3COO- 完成下列填空:(1)如果要提高上述反应的反应速率,可以采取的措施是bc(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为C>N>O>H
(4)通过比较NH3和PH3的稳定性可判断氮、磷两种元素的非金属性强弱.
分析 (1)增大浓度、升高温度等,可增大反应速率;
(2)氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵;
(3)铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小;
(4)比较非金属性强弱,可根据氢化物的稳定性强弱判断.
解答 解:(1)增大浓度、升高温度等,可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
(2)氨气、水、二氧化碳可反应生成碳酸铵或碳酸氢铵,方程式为2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3,
故答案为:2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;
(3)铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径C>N>O>H;故答案为:C>N>O>H;
(4)比较非金属性强弱,可根据氢化物的稳定性强弱,
故答案为:NH3和PH3的稳定性;
点评 本题主要考查了元素周期律、化学平衡移动等问题的考查,综合考查学生的分析能力和双基知识,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
5.将等物质的量的X、Y气体充入一容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)???2M(s)+2Z(g)△H<0.若改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
| 改变的条件 | 正、逆反应速率变化 | 新平衡与原平衡比较 | |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | X的体积分数增大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定 量的Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法或有关化学用语的表达正确的是( )
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1-→1s22s22p6 的变化需要吸收能量 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
9.化学在生产和日常生活中有着重要的作用.下列有关说法不正确的是( )
| A. | 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 只要符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| C. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
4.在NaAlO2溶液中,通入amolHCl气体,生成bmol沉淀后,又通入cmolHCl气体时,沉淀恰好溶解,则原NaAlO2溶液中含NaAlO2的物质的量是( )
| A. | $\frac{a+b}{4}$mol | B. | $\frac{a+c}{4}$mol | C. | $\frac{3a+c}{4}$mol | D. | cmol或$\frac{b}{3}$mol |
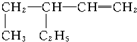 名称:3-乙基-1-戊烯.
名称:3-乙基-1-戊烯. 名称:5-甲基-2-己烯.
名称:5-甲基-2-己烯. 名称:5-甲基-3-庚炔.
名称:5-甲基-3-庚炔.
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;