题目内容
15.已知A、B、C是单质,D、E、F是化合物.A是第三周期原子序数最小的元素,B是除稀有气体外第三周期原子序数最大的元素,E是一种淡黄色固体,A、B、C、D、E、F之间有如图所示转化关系
(1)A在元素周期表中的位置是第三周期第ⅠA族
(2)写出D和F的化学式Na2O、NaCl
(3)写出E与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.
分析 A、B、C是单质,D、E、F是化合物.A是第三周期原子序数最小的元素,则A为Na,B是除稀有气体外第三周期原子序数最大的元素,则B为Cl2,E是一种淡黄色固体,A点燃生成E,则E为Na2O2,C为O2,A与氧气没有点燃的条件下生成D为Na2O,A与B反应生成F为NaCl,据此答题.
解答 解:A、B、C是单质,D、E、F是化合物.A是第三周期原子序数最小的元素,则A为Na,B是除稀有气体外第三周期原子序数最大的元素,则B为Cl2,E是一种淡黄色固体,A点燃生成E,则E为Na2O2,C为O2,A与氧气没有点燃的条件下生成D为Na2O,A与B反应生成F为NaCl,
(1)A为Na,A在元素周期表中的位置是第三周期第ⅠA族,
故答案为:第三周期第ⅠA族;
(2)根据上面的分析可知,D为Na2O,F为NaCl,
故答案为:Na2O、NaCl;
(3)E为Na2O2,E与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑.
点评 本题考查无机物推断,涉及Na元素化合物性质,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
3.组成C11H16为的芳香烃,其苯环上有两个取代基的同分异构体数目为( )
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
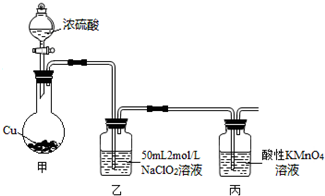
10. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
7.在一定条件下,向2L密闭容器中充入3mol X气体和1mol Y气体,发生下列反应:2X(气)+Y(气)?3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是( )
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
 .
.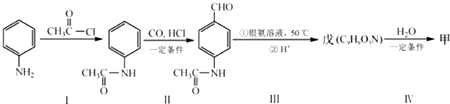
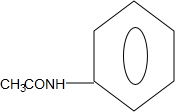 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$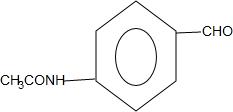 .
.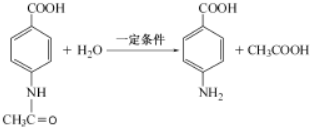 .
.