题目内容
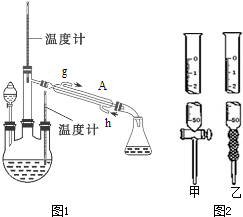
8.下面是甲、乙、丙三位同学制取乙酸乙酯的实验,请你参与并协助他们完成相关实验任务.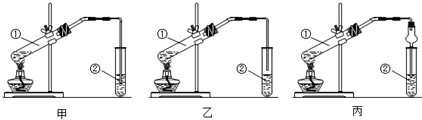
【实验原理】该反应为CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是吸水剂、催化剂.
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
甲、乙两同学设计的装置中,正确的是乙(选填“甲”或“乙”);丙同学将玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是防止倒吸.
【实验步骤】
(1)按我选择的装置组装仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
(2)将试管固定在铁架上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验.
【问题讨论】
a.步骤(1)中加入的乙醇比乙酸多目的是促进乙酸转化,有利于生成乙酸乙酯.
b.试管②中饱和Na2CO3的作用是
①吸收乙醇②除去乙酸③降低乙酸乙酯的溶解度.
c.从试管②中分离出乙酸乙酯的实验操作名称是分液.
分析 【实验原理】乙酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,该反应可逆反应;浓硫酸具有吸水性,可促进反应正向进行;
【装置设计】装置中②的导管不能伸入液面以下,否则容易发生倒吸现象,则装置甲会发生倒吸现象,装置乙合理;丙中球形干燥管还可以防止倒吸;【问题讨论】
【问题讨论】
a.该反应为可逆反应,乙醇过量可促进乙酸转化;
b.实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;
c.乙酸乙酯与碳酸钠溶液分层.
解答 解:【实验原理】酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,浓硫酸具有吸水性,减少生成物可促进反应正向进行,且作催化剂加快反应速率,
CH3COOCH2CH3+H2O,浓硫酸具有吸水性,减少生成物可促进反应正向进行,且作催化剂加快反应速率,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;吸水剂;催化剂;
CH3COOCH2CH3+H2O;吸水剂;催化剂;
【装置设计】乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,故答案为:乙;防止倒吸;
【问题讨论】
a.该反应为可逆反应,乙醇过量可促进乙酸转化,则步骤(1)中加入的乙醇比乙酸多目的是促进乙酸转化,有利于生成乙酸乙酯,故答案为:促进乙酸转化,有利于生成乙酸乙酯;
b.碳酸钠溶液能够吸收乙醇,能跟乙酸反应中和乙酸,便于闻到乙酸乙酯的香味,且乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出,
故答案为:吸收乙醇;除去乙酸;降低乙酸乙酯的溶解度;
c.乙酸乙酯与碳酸钠溶液分层,则从试管②中分离出乙酸乙酯的实验操作名称是分液,故答案为:分液.
点评 本题考查制备实验方案的设计,为高频考点,把握制取乙酸乙酯的反应原理及实验室的制备方法,明确浓硫酸、饱和碳酸钠溶液的作用,特别注意吸收乙酸乙酯的导管不能伸入液面以下,否则会发生倒吸现象等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 优等生题库系列答案
优等生题库系列答案| A. | 分子中N-C-N键角为90° | |
| B. | C(N3)4中碳元素为正价,C(N3)4分子中存在极性键和非极性键 | |
| C. | C(N3)4就是石墨吸附N2后所得的物质 | |
| D. | 该物质为分子晶体,每18g C(N3)4完全分解可产生13.44L的气体 |
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:5 |
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | S2- | B. | Ca2+ | C. | F- | D. | Cl- |

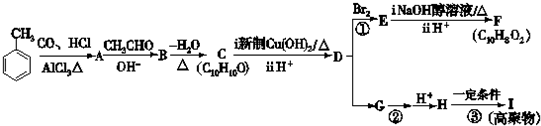
 .
. +2Cu(OH)2
+2Cu(OH)2 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.
 +nH2O.
+nH2O. .
.