题目内容
【题目】(1)某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气,若反应后生成AlO2-,则溶液中一定存在的离子有______________,一定不存在的离子有______________,可能存在的离子有__________________,该溶液与铝反应放出氢气的离子方程式为_____________________________________。
(2)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,某兴趣小组首先将其制成水溶液。
①通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是___,
②书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式___。
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是___。试解释原因:___。有同学提出加入CuO以除去Fe3+。你认为理由是___。
(4)能不能直接蒸发CuCl2溶液得到CuCl2·2H2O晶体?___(填“能”或“不能”)。若能,不用回答;若不能,说明理由___。
(5)将FeCl3固体溶于蒸馏水配制溶液时常会出现浑浊,得不到澄清的氯化铁溶液,其原因是___,如果要得到澄清的氯化铁溶液,可采取的措施是___。
(6)泡沫灭火器使用NaHCO3和Al(SO4)3溶液反应产生CO2来灭火。试从平衡移动的角度分析以上两种溶液反应产生CO2的原因:____________________
【答案】Na+、OH Mg2+、H+、Ag+、HCO3- Cl 2Al+2OH-+2H2O=2AlO2-+3H2↑ 可观察到白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 氢气(H2) 镁粉与FeCl3、CuCl2水解产生的H+反应而生成氢气 CuO能与酸反应既不带入新的杂质,又能使得溶液pH升高,Fe3+沉淀 不能 加热使得上述水解程度增大,随着盐酸的挥发,平衡不断朝正反应方向移动最终得到Cu (OH)2 Fe3+易水解,水解生成HFe(OH)3导致溶液变浑浊,Fe3++3H2O→Fe(OH)3+3H+ 加入盐酸抑制铁离子的水解 HCO3-+H2O![]() H2CO3+OH-、Al3++3H2O
H2CO3+OH-、Al3++3H2O![]() Al(OH)3↓+3H+,两个反应相互促进水解平衡正向移动,碳酸分子浓度达到一定数值就会分解为二氧化碳和水。
Al(OH)3↓+3H+,两个反应相互促进水解平衡正向移动,碳酸分子浓度达到一定数值就会分解为二氧化碳和水。
【解析】
(1)跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析,并注意离子在水中的颜色;
(2)将氢氧化钠溶液加入氯化亚铁溶液,先生成白色氢氧化亚铁,氢氧化亚铁不稳定,以被氧化生成氢氧化铁;
(3)FeCl3、CuCl2溶液呈酸性,在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是氢气,加入CuO,可起到溶液pH的作用,有利于铁离子的水解;
(4)加热使得上述水解程度增大;
(5)Fe3+易水解,水解生成Fe(OH)3导致溶液变浑浊,可加入盐酸抑制FeCl3水解;
(6)HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3。
(1)溶液和铝粉反应后有AlO2-生成,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含Cl-;
(2)将氢氧化钠溶液加入氯化亚铁溶液,先生成白色氢氧化亚铁,氢氧化亚铁不稳定,以被氧化生成氢氧化铁,发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,可观察到白色沉淀,迅速变成灰绿色,最终变成红褐色;
(3)FeCl3、CuCl2溶液呈酸性,在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是氢气,加入CuO,可起到溶液pH的作用,有利于铁离子的水解,且不引入杂质;
(4)加热使得上述水解程度增大,随着盐酸的挥发,平衡不断朝正反应方向移动最终得到Cu(OH)2;
(5)Fe3+易水解,水解生成Fe(OH)3导致溶液变浑浊,水解的离子方程式为Fe3++3H2O=Fe(OH)3+3H+,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊;
(6)HCO3-和Al3+均可发生水解,且相互促进,产生气体CO2和沉淀Al(OH)3,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
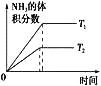
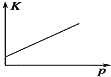
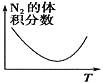
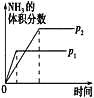
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是
A | B | C | D | |
研究目的 | 温度(T)对反应的影响(T2>T1) | 压强(p)对平衡常数的影响 | 温度(T)对反应的影响 | 压强(p)对反应的影响(p2>p1) |
图示 |
|
|
|
|
A.AB.B .C.CD.D