题目内容
【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
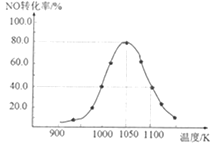
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
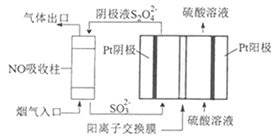
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。
【答案】6a+12b-5c-12d < 1 1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】
(1)反应的ΔH等于反应物的总键能减去生成物的总键;
(2)①根据升温对反应2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1的平衡移动及反应速率的影响幅度来判断;
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1的平衡移动及反应速率的影响幅度来判断;
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,用三段式求出平衡时各物质的浓度,再按照平衡时正逆反应速率相等来计算;
(3)假如已平衡,升温平衡应左移,转化率下降,之所以有矛盾,从假设不成立角度分析;
(4)①阴极区发生还原反应,从图中找出阴极反应物,写它发生还原反应的电极反应式;
②NO吸收转化后的主要产物为NH4+,写出关系式,按电子数守恒,求出一氧化氮在标准状况下体积;
(1)反应的ΔH等于反应物的总键能减去生成物的总键,ΔH=(6a+12b-5c-12d)kJ·mol-1;
答案为:6a+12b-5c-12d;
(2)①该反应的正反应是放热反应,达到平衡后,仅升高温度,平衡逆向移动,所以逆反应速率大于正反应速率,则正反应速率增大的倍数小于逆反应速率增大的倍数,所以k正增大的倍数<k逆增大的倍数;
答案为:<;
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%, 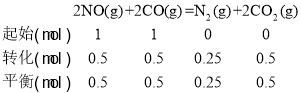 平衡时正逆反应速率相等,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),则 k正·c2(NO)·c2(CO) =k逆·c(N2)·c2(CO2),因为是1L的密闭容器,k正×0.52×0.52=k逆·×0.25×0.52,则
平衡时正逆反应速率相等,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),则 k正·c2(NO)·c2(CO) =k逆·c(N2)·c2(CO2),因为是1L的密闭容器,k正×0.52×0.52=k逆·×0.25×0.52,则![]() =1;
=1;
答案为:1;
(3)假如已平衡,升温平衡应左移,转化率下降,而当反应在建立平衡的过程中时,随着温度升高,反应速率加快,NO转化率增大;
答案为:1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;
(4)①由图可知,阴极区通入液体主要含SO32-,流出主要含S2O42-,所以阴极区电极反应式为2SO32-+4H++2e-=S2O42-+2H2O;
答案为:2SO32-+4H++2e-=S2O42-+2H2O;
②NO吸收转化后的主要产物为NH4+,若通电一段时间后阴极区n(SO32-)减少了0.3mol,此过程转移0.3mole;由于NO吸收转化后的主要产物为NH4+,NO~NH4+~5e,若电路中转移转移0.3mole,消耗NO0.06mol,标准状况下体积为V(NO)=0.06mol×22.4L/mol=1.344L=1344mL;
答案为:1344。

【题目】工业上CO2、CH4等含碳化合物有着重要的应用。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:__。
物质 | 标准燃烧热/kJ·mol-1 |
氢气 | -285.8 |
甲烷 | -890.3 |
乙烯 | -1411.0 |
(2)在400℃时,向初始体积为1L的恒容密闭反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。
①该温度下,平衡常数K=__。
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将___(填“正向移动”或“逆向移动”或“不移动”成“无法确定”),理由是__。
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。
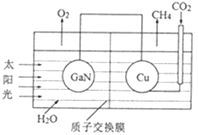
①该电化学装置属于__(填“原电池”或“电解池”)。
②该电池的Cu电极上发生反应的电极方程式为__。


