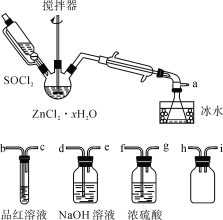
题目内容
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为:______________________________(注明你的表达式中所用的有关符号的含义和单位)。
【答案】托盘天平 250 mL的容量瓶 2Na2SO3+ O2=2Na2SO4 使SO32-充分转化为气体,使SO42-完全沉淀 静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成 偏高 < 方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大 a ![]() V—mL,c—mol/L
V—mL,c—mol/L
【解析】
(1)配制250mL Na2SO3溶液时,用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙、托盘天平、250mL容量瓶;
(2)Na2SO3固体氧化变质生成硫酸钠;
(3)方案I是利用生成的硫酸钡沉淀计算样品中硫酸钠的质量,再计算亚硫酸钠的纯度,而亚硫酸钠也会与氯化钡反应生成沉淀,影响硫酸钡质量的测定,需要出去亚硫酸钠; SO42-完全沉淀时,上层清液中没有SO42-,再加入氯化钡溶液也没有沉淀生成;
(4)方案I中,若滤液浑浊,说明滤液中含有硫酸钡,导致沉淀硫酸钡的质量偏小,计算样品中硫酸钠的质量偏小;
(5)酸性条件下,硝酸根将亚硫酸根氧化为硫酸根,导致硫酸钡质量增大;
(6)依据试剂的性质和滴定实验达到终点的颜色分析判断选择标准溶液;依据高锰酸钾和亚硫酸根离子反应的定量关系计算得到;V-消耗KMnO4溶液体积为 V mL,KMnO4溶液浓度为c mol/L,计算高锰酸钾的物质的量,根据电子转移守恒计算Na2SO3的物质的量,进而计算样品的纯度。
(1)用天平称量固体质量,用到药匙,在烧杯中溶解,并用玻璃棒搅拌,用玻璃棒引流移入250mL容量瓶中,加水至刻度线1-2cm出改用胶头滴管定容;
故答案为:托盘天平、250mL容量瓶;
(2)Na2SO3固体氧化变质生成硫酸钠,反应方程式为:2Na2SO3+O2=2Na2SO4 ,
故答案为:2Na2SO3+O2=2Na2SO4 ;
(3)方案I是利用生成的硫酸钡沉淀计算样品中硫酸钠的质量,再计算亚硫酸钠的纯度,而亚硫酸钠也会与氯化钡反应生成沉淀,影响硫酸钡质量的测定,需要出去亚硫酸钠,加入过量的盐酸酸化的BaCl2溶液,目的是:使SO32-充分转化为气体,在过滤前,需要检验是否沉淀完全,其操作是:静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成,
故答案为:使SO32-充分转化为气体;静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成;
(4)方案I中,若滤液浑浊,说明滤液中含有硫酸钡,导致沉淀硫酸钡的质量偏小,计算样品中硫酸钠的质量偏小,则计算亚硫酸钠的质量分数偏高,
故答案为:偏高;
(5)方案II中盐酸提供H+,Ba(NO3)2提供NO3-形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大,
故答案为:<;方案II中盐酸提供H+,Ba(NO3)2提供NO3-形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大;
(6)取25.00mL上述溶液,用滴定的方法测定Na2SO3的纯度,下列试剂可作为标准溶液进行滴定的必须是安全,反应现象明显,终点易于判断分析判断;
a.酸性KMnO4溶液,滴入最后一滴溶液由无色变化为紫红色,证明反应达到终点,故a符合;
b.H2O2溶液可以氧化亚硫酸钠为硫酸钠,反应终点无明显现象,故b不符合;
c.Br2水 是易挥发的物物质,乙产生有毒的溴蒸气,故不做标准液,故c不符合; d.FeCl3溶液滴入反应,溶液变化为浅绿色,溶液颜色变化不明显,不能指示反应终点,故d不符合;故选a;
V-消耗KMnO4溶液体积为V mL,KMnO4溶液浓度为c mol/L,则消耗高锰酸钾的物质的量为0.001V L×c mol/L=0.001Vcmol,根据电子转移守恒,Na2SO3的物质的量为0.001Vc mol×2.5=0.002.5Vcmol,其质量为0.002.5Vcmol×126g/mol=0.315Vcg,故250mL溶液中亚硫酸质量为0.315Vcg×![]() =3.15Vcg,则样品中亚硫酸钠的质量为
=3.15Vcg,则样品中亚硫酸钠的质量为![]() ;
;
故答案为:a;![]() 。
。

【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
【题目】室温下进行下列实验,根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用Zn和稀硫酸反应制取氢气,向反应液中滴入几滴CuSO4溶液,产生气泡的速率明显加快 | Cu2+是反应的催化剂 |
B | 向滴有酚酞的1mL0.1mol·L-1Na2CO3溶液中加水稀释至10mL,红色变浅 | 加水稀释时,CO32—的水解平衡向逆反应方向移动 |
C | 向5 mL 0.1 mol·L-1 KI溶液中加入0.1 mol·L-1 FeCl3溶液1 mL,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液,出现血红色 | 反应2Fe3++2I-=2Fe2++I2是有一定限度的 |
D | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生 | Ksp(BaCO3)<Ksp(BaSO4) |
A.AB.BC.CD.D
【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
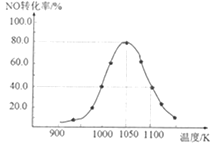
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
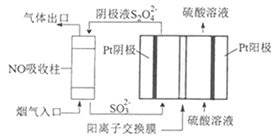
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。