��Ŀ����
����Ŀ����ҵ��CO2��CH4�Ⱥ�̼������������Ҫ��Ӧ�á�
��1����ѧ����CH4Ϊԭ�����Ʊ���ϩ��ͬʱ�õ���������֪������ʵı�ȼ�������±���ʾ��д�������Ʊ���ϩ���Ȼ�ѧ����ʽ��__��
���� | ��ȼ����/kJ��mol-1 |
���� | -285.8 |
���� | -890.3 |
��ϩ | -1411.0 |
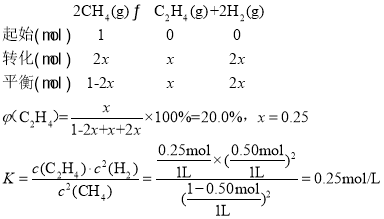
��2����400��ʱ�����ʼ���Ϊ1L�ĺ����ܱշ�Ӧ���г���1molCH4������������Ӧ�����ƽ����������C2H4���������Ϊ20.0%��
�ٸ��¶��£�ƽ�ⳣ��K=__��
�������ƽ����ϵ�г�������ʵ�����CH4��H2����ƽ�⽫___�����������ƶ������������ƶ����������ƶ���������ȷ��������������__��
��3����ѧ���õ����ز�����ͭ��װ����ͼ��ʾ���˹����ϵͳʵ��CO2�������á�
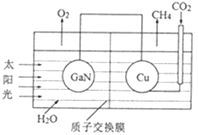
�ٸõ绯ѧװ������__������ԭ�������������������
�ڸõ�ص�Cu�缫�Ϸ�����Ӧ�ĵ缫����ʽΪ__��
���𰸡�2CH4(g)![]() C2H4(g)+2H2(g) ��H=+202.0kJ��mol-1 0.25 ���ƶ� ��Ӧƽ�ⳣ���ı���ʽΪK=
C2H4(g)+2H2(g) ��H=+202.0kJ��mol-1 0.25 ���ƶ� ��Ӧƽ�ⳣ���ı���ʽΪK= ������ƽ����ϵ��c(CH4)=c(H2)����������ʵ����ļ��������������Ũ����Ȼ��ȣ���Qc=K��ƽ�ⲻ�ƶ� ԭ��� CO2+8e-+8H+=CH4+2H2O
������ƽ����ϵ��c(CH4)=c(H2)����������ʵ����ļ��������������Ũ����Ȼ��ȣ���Qc=K��ƽ�ⲻ�ƶ� ԭ��� CO2+8e-+8H+=CH4+2H2O
��������
��1����������ʵı�ȼ����д�Ȼ�ѧ����ʽ�����ø�˹���ɿ�д�������Ʊ���ϩ���Ȼ�ѧ����ʽ��
��2�����ճ�ʼ���Ϊ1L�ĺ����ܱշ�Ӧ���г���1molCH4��ƽ����������C2H4���������Ϊ20.0%��
��ͨ������ʽ������¶��µ�ƽ�ⳣ��K��
�������ƽ����ϵ�г�������ʵ�����CH4��H2��ͨ��Ũ������ƽ�ⳣ���Ĵ�С���жϣ�
��3�����ͼʾ��Ϣ�ش�
�ٸõ绯ѧװ��ԭ��أ�
��Cu�缫��CO2ת��ΪCH4���ɾݴ�д�缫����ʽΪ��
��1����֪����![]() ��
��![]() ��
��![]() �����Ʊ���ϩ�Ļ�ѧ����ʽΪ��2CH4(g)
�����Ʊ���ϩ�Ļ�ѧ����ʽΪ��2CH4(g)![]() C2H4(g)+2H2(g)����Ӧ���ɢ���2������2�õ������ݸ�˹���ɣ���Ӧ���ʱ�Ϊ��H =2��H 2��H 32��H 1=+202.5kJ/mol��
C2H4(g)+2H2(g)����Ӧ���ɢ���2������2�õ������ݸ�˹���ɣ���Ӧ���ʱ�Ϊ��H =2��H 2��H 32��H 1=+202.5kJ/mol��
����2CH4(g)![]() C2H4(g)+2H2(g) ��H=+202.0kJ��mol-1��
C2H4(g)+2H2(g) ��H=+202.0kJ��mol-1��
��2�����ճ�ʼ���Ϊ1L�ĺ����ܱշ�Ӧ���г���1molCH4��ƽ����������C2H4���������Ϊ20.0%��
�� ��
��
����0.25��
�����ϼ����֪��ƽ����ϵ��c(CH4)=c(H2)=0.5mol/L�������ƽ����ϵ�г�������ʵ�����CH4��H2����c(CH4)��c(H2)��Ȼ��ȣ��ɼ���Ũ���̣�Qc= =K����ƽ�ⲻ�ƶ���
=K����ƽ�ⲻ�ƶ���
��Ϊ�����ƶ�����Ӧƽ�ⳣ���ı���ʽΪK= ������ƽ����ϵ��c(CH4)=c(H2)����������ʵ����ļ��������������Ũ����Ȼ��ȣ�Qc=K����ƽ�ⲻ�ƶ���
������ƽ����ϵ��c(CH4)=c(H2)����������ʵ����ļ��������������Ũ����Ȼ��ȣ�Qc=K����ƽ�ⲻ�ƶ���
��3���ٽ��ͼʾ��Ϣ��װ��û����ӵ�Դ���õ绯ѧװ��Ϊԭ��أ�
��Ϊ��ԭ��أ�
�ڵ�ص�Cu�缫��CO2ת���CH4���ǻ�ԭ��Ӧ���ݴ˿�д�缫����ʽΪCO2+8e-+8H+=CH4��
����CO2+8e-+8H+=CH4+2H2O��

����Ŀ�������������������������ķ�չ������о��ȵ㡣
��1����NH3ѡ�����ѳ�������������·�Ӧ��
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
��֪��ѧ���ļ����������±���
��ѧ�� | NO�еĵ����� | N-H | N | O-H |
���ܣ�kJ��mol-1�� | a | b | c | d |
��÷�Ӧ����H=__kJ��mol-1��
��2��������β���ľ���װ����CO��NO������Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO(g) ��H=-746.8kJ��mol-1��
N2(g)+2CO(g) ��H=-746.8kJ��mol-1��
ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ�
�ٴ�ƽ��������¶ȣ�k������ı���__k������ı���������������������������������
������1L���ܱ������г���1molCO��1molNO����һ���¶��´ﵽƽ�⣬CO��ת����Ϊ50%����![]() =__��
=__��
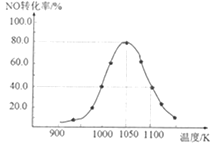
��3�������÷�Ӧ��ȥ����β���е�NOx��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H=-34.0kJ��mol-1�����ܱ������з����÷�Ӧ������Ӧ��ͬʱ�䣬��ò�ͬ�¶���NO��ת����a��NO�����¶ȵı仯��ͼ��ʾ����ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�����ԭ����__��
N2(g)+CO2(g) ��H=-34.0kJ��mol-1�����ܱ������з����÷�Ӧ������Ӧ��ͬʱ�䣬��ò�ͬ�¶���NO��ת����a��NO�����¶ȵı仯��ͼ��ʾ����ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�����ԭ����__��
��4���������������S2O42-��Ϊý�飬ʹ�ü�ӵ绯ѧ��Ҳ�ɴ���ȼú�����е�NO��װ����ͼ��ʾ��
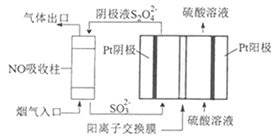
���������ĵ缫��ӦʽΪ__��
��NO����ת�������Ҫ����ΪNH4+����ͨ��ʱ��·��ת����0.3mole-�����ͨ����������������յ�NO�ڱ�״���µ����Ϊ__mL��