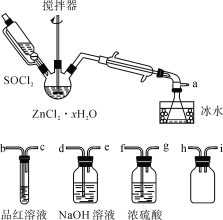
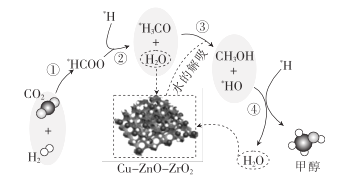
题目内容
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是

A. 五种元素中,原子半径最大的是W
B. Y与Z形成的化合物都可以和盐酸反应
C. 简单阴离子的还原性:Y>W
D. Z与Q形成的化合物水溶液一定显酸性
【答案】B
【解析】试题分析:W的单质是黄色固体,W是硫元素;原子序数依次增大,Q是氯元素;Y是氧元素;X是碳元素;只有Z是金属,Z一定是第三周期元素。五种元素中,原子半径最大的是Z,故A错误;Y与Z形成的金属氧化物都可以和盐酸反应,故B正确;简单阴离子的还原性:S2->O2-,故C错误;若Z是钠,氯化钠水溶液呈中性,故D错误。

【题目】(1)下列数据是对应物质的熔点(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
据此作出的下列判断中,错误的是_____。
A 铝的化合物晶体中不存在离子晶体
B 表中只有BCl3、干冰是分子晶体
C 同族元素的氧化物可形成不同类型的晶体
D 不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si原子数目和Si﹣O键数目的比例为_____。
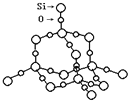
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),该反应的反应热△H=__________。
(3)单质铝晶体晶胞特征如图乙所示.则晶胞中铝原子的配位数为_____,晶胞中存在两种空隙,分别是___________、___________。

【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
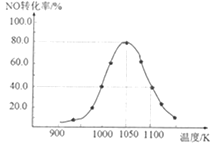
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
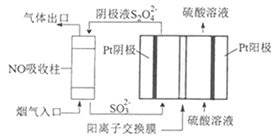
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。