题目内容
【题目】生活污水中氮是造成水体富营养化的主要原因。若某污水中NH4Cl含量为180mg/L。
(1)写出NH4Cl电子式:___。
(2)氮原子的电子排布式是:___,写出与氯同周期,有2个未成对电子的原子的元素符号为___、___。
(3)为除去废水中的NH4+,向103L该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH溶液的体积为___L(计算结果保留两位小数)。
(4)可先在酸性污水中加入铁屑将NO3-转化为NH4+后再除去,请配平下列离子方程式并标出电子转移的方向和数目___。
___Fe+___NO3-+___H+→___Fe2++___NH4++___H2O
【答案】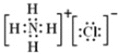 Si S 1s22s22p3 33.64
Si S 1s22s22p3 33.64 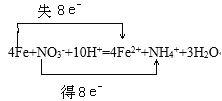 4 1 10 4 1 3
4 1 10 4 1 3
【解析】
(1)NH4Cl是离子化合物;
(2)氮为7号元素;氯原子的核外电子排布式为1s22s22p63s23p5;
(3)根据NH4+和NaOH溶液的反应计算需要NaOH溶液的体积为;
(4)根据氧化还原反应,配平离子方程式并标出电子转移的方向和数目。
(1)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: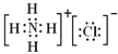 ;
;
(2)氮原子电子排布式是:1s22s22p3;氯原子的核外电子排布式为1s22s22p63s23p5,有一个未成对的电子,与其同周期且有2个未成对电子的原子的的核外电子排布式为1s22s22p63s23p4和1s22s22p63s23p2,元素符号为S、Si;
(3) 某污水中NH4Cl含量为180mg/L,103L污水中含有180mg/L×103L =180000mg=180gNH4Cl,NH4Cl的物质的量为![]() ≈3.364mol,NH4+的物质的量也是3.364mol,为除去废水中的NH4+,向该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH的物质的量为3.364mol,则所需NaOH溶液的体积为
≈3.364mol,NH4+的物质的量也是3.364mol,为除去废水中的NH4+,向该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH的物质的量为3.364mol,则所需NaOH溶液的体积为![]() =33.64L;
=33.64L;
(4)该反应中铁元素的化合价由0价升高至+2价,氮元素的化合价由+5价降低至-3价,由化合价升降守恒和质量守恒可以配平该离子方程式并标出电子转移的方向和数目如下: 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
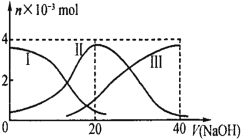
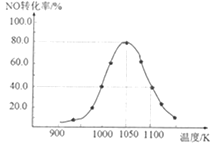
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
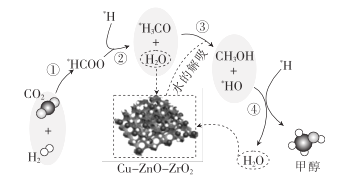
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
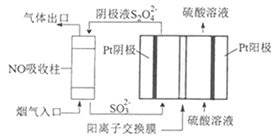
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。
【题目】不同元素的原子吸引电子的能力大小可用一定数值X表示,X值越大,其原子吸引电子的能力越强,在所形成的化合物中为带负电荷的一方。下表是某些元素的X值:
元素符号 |
|
|
|
|
|
|
X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 |
|
|
|
|
|
|
X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
(1)通过分析X值的变化规律,确定![]() 、
、![]() 的X值范围:______
的X值范围:______![]() ______;______
______;______![]() ______。
______。
(2)推测X值与原子半径的关系为______。
(3)某有机化合物的结构为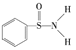 ,其中
,其中![]() 键中,你认为共用电子对偏向______(填元素符号)。
键中,你认为共用电子对偏向______(填元素符号)。
(4)如果X值为电负性的数值,试推断![]() 中化学键的类型为______。
中化学键的类型为______。
(5)预测元素周期表中X值最小的元素(放射性元素除外)是______(填元素符号)。