题目内容
4.X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种物质中的一种.下表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH.| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)W的电离方程式是NH4NO3═NH4++NO3-.
(3)常温下,W的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将浓度均为1mol/L的X、Z两种溶液各取20mL配成混合溶液,该混合溶液中各离子的浓度由大到小的顺序是c(Na+)>c(OH-)>c(NO2-)>c(H+).
分析 X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种,0.01mol/L的X溶液pH=12,说明X为强碱,则X为NaOH;
0.01mol/L的Y溶液pH=2,说明Y为强酸,则Y为HNO3;
0.01mol/L的Z溶液pH=8.5,说明Z为强碱弱酸盐,则Z为NaNO2;
0.01mol/L的W溶液pH=4.5,说明W为强酸弱碱盐,则W为NH4NO3,再结合物质的性质来分析解答.
解答 解:X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种,0.01mol/L的X溶液pH=12,说明X为强碱,则X为NaOH;
0.01mol/L的Y溶液pH=2,说明Y为强酸,则Y为HNO3;
0.01mol/L的Z溶液pH=8.5,说明Z为强碱弱酸盐,则Z为NaNO2;
0.01mol/L的W溶液pH=4.5,说明W为强酸弱碱盐,则W为NH4NO3,
(1)通过以上分析知,X为NaOH,Z为NaNO2,
故答案为:NaOH、NaNO2;
(2)W为NH4NO3,硝酸铵为强电解质,在水溶液里完全电离为氢根离子和硝酸根离子,电离方程式为:NH4NO3═NH4++NO3-,
故答案为:NH4NO3═NH4++NO3-;
(3)W为NH4NO3,硝酸铵为强酸弱碱盐,铵根离子部分水解,溶液呈酸性,水解离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(4)X为NaOH,Z为NaNO2,X、Z各1mol•L-1同时溶于水中制得混合溶液为碱性溶液,则:c(OH-)>c(H+),钠离子不水解,亚硝酸根离子部分水解,所以离子浓度大小关系为:c(Na+)>c(OH-)>c(NO2-)>c(H+),
故答案为:c(Na+)>c(OH-)>c(NO2-)>c(H+).
点评 本题考查了盐的水解原理及其应用,题目难度中等,涉及电离方程式书写、离子浓度大小比较、物质推断等知识,明确盐的水解原理为解答关键.

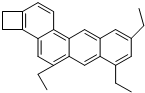 如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为doggycene,有关doggycene的说法不正确的是( )
如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为doggycene,有关doggycene的说法不正确的是( )| A. | 该分子中所有碳原子可能处于同一平面 | |
| B. | doggycene的分子式为C26H26 | |
| C. | 1mol该物质在氧气中完全燃烧生成CO2和水的物质的量之比为2:1 | |
| D. | 该物质常温下为气态 |
| 元素 | 性质或结构信息 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
.(2)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是共价化合物还是离子化合物?离子化合物,甲中的化学键类型为离子键和共价键.
(3)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
| A. | 2A+3B=3C | B. | 3A+2B=2C | C. | 2A+2B=3C | D. | 2A+3B=2C |
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ•mol -1 | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol/L盐酸 | D. | 提高溶液的温度 |
| A. | 将FeCl3溶液直接蒸干制取无水FeCl3固体 | |
| B. | 配制CuSO4溶液时,需加入少量的稀硫酸以抑制Cu2+水解 | |
| C. | 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差 | |
| D. | 用广泛pH试纸测定溶液pH时,试纸需预先用蒸馏水湿润 |

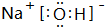 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.