题目内容
20.控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )
| A. | 反应开始时,甲中石墨电极上Fe3+被还原 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 平衡时甲中溶入FeCl2固体后,电流计读数为零 |
分析 据常温下能自动发生的氧化还原反应都可设计成原电池,再利用正反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,并利用平衡移动来分析解答.
解答 解:A、由总反应方程式知,Fe3+被还原成Fe2+,则发生还原反应,故A正确;
B、反应开始时,乙中碘离子失电子发生氧化反应,电极反应式为:2I--2e-=I2,故B正确;
C、当电流计为零时,说明没有电子发生转移,则反应达到平衡,故C正确;
D、当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,故D错误;
故选D.
点评 本题是对原电池原理综合考查,并注重与化学平衡的联系,学生明确原电池的工作原理、正负极的判断方法、化学平衡的移动即可解答.

练习册系列答案
相关题目
10.下列实验操作或对实验事实的叙述正确的是( )
| A. | 实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水. | |
| B. | 实验室用溴水、苯和铁粉反应制取溴苯,向粗溴苯中加入10%的NaOH溶液进行洗涤,可以除去溶解在溴苯中的溴单质. | |
| C. | 煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯. | |
| D. | 多数有机反应很慢,往往需要加热,采用水浴加热易控制温度且受热均匀,石油分馏、苯和浓硝酸发生取代反应、银镜反应、油脂水解均必需水浴加热. | |
| E. | 用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质. |
11.实验室制取下列气体可以用启普发生器的是( )
| A. | 用硫化亚铁固体和稀硫酸制备硫化氢 | |
| B. | 用亚硫酸钠固体与浓硫酸制备二氧化硫 | |
| C. | 用碳酸钙固体与稀硫酸制备二氧化碳 | |
| D. | 用生石灰与浓氨水制备氨气 |
8.表示金属冶炼原理的化学反应中,不可能有( )
| A. | 氧化还原反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
15.已知A是组成有机物的必须元素,元素B~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为 .
.
(2)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是共价化合物还是离子化合物?离子化合物,甲中的化学键类型为离子键和共价键.
(3)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
| 元素 | 性质或结构信息 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
.(2)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是共价化合物还是离子化合物?离子化合物,甲中的化学键类型为离子键和共价键.
(3)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
5.下列排列顺序不正确的是( )
| A. | 离子半径:Cl->Mg2+>Na+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 非金属性:Cl>Br>I |
10.下列反应能够瞬间完成的是( )
| A. | 硝酸与铜的反应 | B. | HNO3(aq)与NaOH(aq)的反应 | ||
| C. | 光照H2与O2的混合物 | D. | 铜绿的生成 |

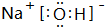 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.