题目内容
(10分)饱和亚硫酸溶液的pKa(电离平衡常数的负对数,即pKa=-lgKa)数据如下:

(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1 Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01 m ol.L-1NaHSO3溶液的pH=bl,0.01 tml·L-1NaHCO3溶液的pH=b2,
b1 b2
(3)向10 mL 0.01 mol·L-1的H2SO3溶液中,滴加0.0l mol·L-1KOH溶液V(mL),
①当V="10" mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+) c(OH-)
②当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V="b" mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3);则a b。
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1 gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为 .

(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1 Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01 m ol.L-1NaHSO3溶液的pH=bl,0.01 tml·L-1NaHCO3溶液的pH=b2,
b1 b2
(3)向10 mL 0.01 mol·L-1的H2SO3溶液中,滴加0.0l mol·L-1KOH溶液V(mL),
①当V="10" mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+) c(OH-)
②当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V="b" mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3);则a b。
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1 gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为 .
(10分)
(1)>(2分)
(2)<(2分)
(3)①>,(2分) ②>(2分)
(4)1000(2分)
(1)>(2分)
(2)<(2分)
(3)①>,(2分) ②>(2分)
(4)1000(2分)
专题:电离平衡与溶液的pH专题.
分析:(1)根据pKa为电离平衡常数的负对数,即pKa=-lgKa,则pKa越小,电离平衡常数Ka越大;
(2)根据pKa越小,电离平衡常数Ka越大,则对应酸的酸性就强,利用酸越弱则强碱弱酸盐的水解程度越大来分析;
(3)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解来分析;
②V="a" mL时由c(K+)=2c(SO32-)+c(HSO3-),则c(H+)=c(OH-);V="b" mL时,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),即溶液中的溶质为KHSO3,溶液显酸性;
(4)利用离子对溶解平衡的影响及Ksp(BaSO4)来计算溶解的硫酸钡的质量,然后确定两种洗涤方法中BaSO4沉淀的损耗量之比.
解答:解:(1)由pKa数据可知,1.9<7.2,由pKa=-lgKa,则pKa越小,电离平衡常数Ka越大,则H2SO3的Ka1>HSO3-的Ka2,
故答案为:>;
(2)由pKa数据可知,亚硫酸的pKa小于碳酸,则酸性比碳酸的强,相同浓度的NaHSO3溶液比NaHCO3溶液中酸根离子的水解程度弱,则NaHSO3溶液的pH小,即bl<b2,故答案为:<;
(3)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解,电离生成氢离子,水解生成氢氧根离子,即c(H+)>c(OH-),故答案为:>;
②V="b" mL时,c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),即溶液中的溶质为KHSO3,溶液显酸性;当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-),由电荷守恒可知c(H+)=c(OH-),即溶液显中性,则向10mL0.01mol?L-1的H2SO3溶液中,滴加0.0l mol?L-1KOH溶液,由酸性变为中性时碱的体积在变大,即a>b,故答案为:>;
(4)用100mL蒸馏水洗涤沉淀时,溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×
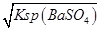 =0.1L×
=0.1L×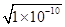 mol/L=10-6mol,
mol/L=10-6mol,用100mL 0.01mo1.L-1H2SO4溶液洗涤时,硫酸根离子抑制了沉淀的溶解,则溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×
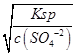 =0.1L×
=0.1L×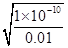 mol/L=10-9mol,
mol/L=10-9mol,由同种物质的质量之比等于物质的量之比,则两种洗涤方法中BaSO4沉淀的损耗量之比为
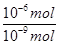 =1000,故答案为:1000.
=1000,故答案为:1000.点评:本题考查溶液中的电离及离子的浓度关系,考查知识点为高考的热点,学生应学会利用信息中的数据来分析是解答本题的关键,然后注重结合所学知识来解答即可.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是( )
。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是( ) 、Cl-
、Cl- 、Br-
、Br- 、Ca2+、Cl-、
、Ca2+、Cl-、
 、Cl-、
、Cl-、 H++HA-,HA-
H++HA-,HA- 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应: