ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΦν ΫΝρΥαΧζ[Fe(OH)SO4 ] «“Μ÷÷–¬–ΆΗΏ–ß–θΡΐΦΝΘ§≥Θ”Ο”ΎΈέΥ°¥ΠάμΘ§‘Ύ“ΫΝΤ…œ“≤Ω…”Ο”Ύ÷ΈΝΤœϊΜ·–‘άΘ―ώ≥ω―ΣΓΘΙΛ“Β…œάϊ”ΟΖœΧζ–Φ(Κ§…ΌΝΩ―θΜ·¬ΝΒ»)…ζ≤ζΦν ΫΝρΥαΧζΒΡΙΛ“’Νς≥Χ»γœ¬Υυ ΨΘΚ

≤ΩΖ÷―τάκΉ”“‘«β―θΜ·Έο–Έ Ϋ≥ΝΒμ ±»ή“ΚΒΡpH»γ±μΥυ ΨΘΚ
≥ΝΒμΈο | Fe(OH) 3 | Fe(OH) 2 | Al(OH) 3 |
ΩΣ Φ≥ΝΒμ | 2.3 | 7.5 | 3.4 |
Άξ»Ϊ≥ΝΒμ | 3.2 | 9.7 | 4.4 |
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Φ”»κ…ΌΝΩNaHCO3 ΒΡΡΩΒΡ «ΒςΫΎ»ή“ΚΒΡpHΘ§≥ΐ»ΞAl3ΘΪ Θ§ΔΌpHΒΡΖΕΈß__________Θ§ΔΎ–¥≥ωΩ…ΡήΖΔ…ζΒΡάκΉ”ΖΫ≥Χ ΫΘΚ________________ΓΘ
Θ®2Θ©‘Ύ ΒΦ …ζ≤ζ÷–Θ§Ζ¥”ΠΔρ÷–≥ΘΆ§ ±Ά®»κO2 Θ§“‘Φθ…ΌNaNO2 ΒΡ”ΟΝΩΘ§O2 ”κNaNO2 ‘ΎΖ¥”Π÷–ΨυΉς__________ΓΘ»τ≤Έ”κΖ¥”ΠΒΡO2 ”–11.2 L(±ξΉΦΉ¥Ωω)Θ§‘ρœύΒ±”ΎΫΎ‘ΦNaNO2 ΒΡΈο÷ ΒΡΝΩΈΣ________ΓΘ
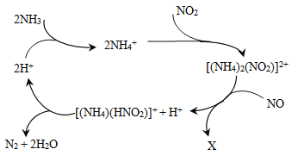
Θ®3Θ©Φν ΫΝρΥαΧζ»ή”ΎΥ°Κσ≤ζ…ζΒΡFe(OH)2ΘΪ Ω…≤ΩΖ÷Υ°Ϋβ…ζ≥…Fe2(OH)42Θ≠Θ§ΗΟΥ°ΫβΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ________________________________________________________________ΓΘ Fe(OH)3 ΒΡKsp =____________ΓΘΘ®Χα ΨΘ§ΩΣ Φ≥ΝΒμc(Fe 3+ )≈®Ε»ΈΣ1.0ΓΝ10 -5 mol/LΘ©
Θ®4Θ©‘Ύ“Ϋ“©…œ≥Θ”ΟΝρΥα―«Χζ”κΝρΥαΓΔœθΥαΒΡΜλΚœ“ΚΖ¥”Π÷Τ±ΗΦν ΫΝρΥαΧζΓΘΗυΨίΈ“Ιζ÷ ΝΩ±ξΉΦΘ§≤ζΤΖ÷–≤ΜΒΟΚ§”–Fe2ΘΪ ΦΑNO3Θ≠ΓΘΈΣΦλ―ιΥυΒΟΒΡ≤ζΤΖ÷– «ΖώΚ§”–Fe2ΘΪ Θ§”Π Ι”ΟΒΡ ‘ΦΝΈΣ________ΓΘ
ΓΨ¥πΑΗΓΩ4.4ΓΪ7.5HΘΪΘΪHCO3Θ≠=CO2ΓϋΘΪH2OΘ§Al3ΘΪΘΪ3HCO3Θ≠=Al(OH)3ΓΐΘΪ3CO2Γϋ―θΜ·ΦΝ2mol2Fe(OH)2ΘΪΘΪ2H2OFe2(OH)42Θ≠ΘΪ2HΘΪ10Θ≠37.4Υα–‘KMnO4»ή“ΚΜρΧζ«ηΜ·ΦΊ
ΓΨΫβΈωΓΩ
Θ®1Θ©ΗΟΙΛ“’Νς≥ΧΒΡΡΩΒΡΈΣ…ζ≤ζΦν ΫΝρΥαΧζΘ§ΖœΧζ–Φ÷–Κ§…ΌΝΩ―θΜ·¬ΝΒ»‘”÷ Θ§Υυ“‘“Σ≥ΐ»ΞAl±ΘΝτFeΘΜΦ”»κœΓΝρΥαΖΔ…ζΖ¥”ΠΔώΘ§‘ρΖ¥”ΠΔώΥυΒΟ»ή“Κ÷–Κ§”–Fe2+ΓΔAl3+ΓΔH+ΓΔSO42-Β»Θ§Φ”»κ…ΌΝΩNaHCO3ΒςΫΎpHΘ§«“ΩΊ÷ΤpH ΙAl3ΘΪ Άξ»Ϊ≥ΝΒμΘ§ΕχFe2 ΘΪ ≤Μ≥ΝΒμΓΘΗυΨί±μΗώ ΐΨίΩ…ΆΤΕœΘ§pH”ΠΩΊ÷Τ‘Ύ4.4ΓΪ7.5ΖΕΈßΡΎΓΘ
Ι ¥πΑΗΈΣΘΚ4.4ΓΪ7.5ΘΜ
Θ®2Θ©ΗυΨίΝς≥ΧΩ…÷ΣΘ§Ζ¥”ΠΔρ÷–ΝρΥα―«ΧζΉΣΜ·ΈΣΝρΥαΧζΘ§Υυ“‘Ά®»κΒΡO2 ”κNaNO2 ΨυΉς―θΜ·ΦΝΘΜ»τ”–11.2 L O2Φ¥0.5mol O2≤Έ”κΖ¥”ΠΘ§‘ρΉΣ“ΤΒγΉ”2molΘΜ»τ”ΟNaNO2Ής―θΜ·ΦΝΘ§ΜΙ‘≠≤ζΈοΈΣNOΘ§ΟΩmol NaNO2ΉΣ“Τ1molΒγΉ”Θ§Υυ“‘±ξΩωœ¬11.2 L
O2 œύΒ±”Ύ2mol NaNO2ΘΜ
Ι ¥πΑΗΈΣΘΚ2molΘΜ
Θ®3Θ©ΗυΨί“―÷Σ–≈œΔΘΚFe(OH)2ΘΪ ΉΣΜ·ΈΣFe2(OH)42Θ≠Θ§Fe‘ΣΥΊΜ·ΚœΦέΟΜ”–ΖΔ…ζΗΡ±δΘ§ΗυΨί‘≠Ή” ΊΚψΩ…÷ΣΘΚ2 Fe(OH)2ΘΪ ΓζFe2(OH)42Θ≠Θ§ΗυΨίΒγΚ… ΊΚψΩ…÷ΣΘ§”Π…ζ≥…HΘΪΓΘΗΟΖ¥”ΠΈΣ≤ΩΖ÷Υ°ΫβΘ§”Π¥ρΓΑΓ±Θ§Υυ“‘άκΉ”ΖΫ≥Χ Ϋ”ΠΈΣΘΚ2Fe(OH)2ΘΪΘΪ2H2OFe2(OH)42Θ≠ΘΪ2HΘΪΘΜΗυΨίFe(OH)3(s) Fe3+(aq)+3OH-(aq)Θ§Ω…ΒΟKsp = c(Fe3+)ΓΝc3 (OH- )ΘΜpH=3.2 ±Θ§Fe3+ΩΣ Φ≥ΝΒμΘ§¥Υ ±c(Fe 3+ )=1.0ΓΝ10 -5 mol/LΘ§c(H+ )=10 -3.2 mol/LΘ§c(OH- )=10-10.8 mol/LΘ§Υυ“‘”–Θ§Ksp = c(Fe3+)ΓΝc3 (OH- )=10-5 ΓΝ(10-10.8 )3 =10-37.4 ΓΘ
Ι ¥πΑΗΈΣΘΚ2Fe(OH)2ΘΪΘΪ2H2OFe2(OH)42Θ≠ΘΪ2HΘΪΘΜ10-37.4ΘΜ
Θ®4Θ©Ω…“‘άϊ”ΟFe2ΘΪΒΡΜΙ‘≠–‘Φλ―ιFe2ΘΪΒΡ¥φ‘ΎΘ§»Γ…ΌΝΩ¥ΐ≤β“ΚΘ§‘ρΒΈ»κΦΗΒΈΥα–‘KMnO4 »ή“ΚΚσΘ§»τ»ή“ΚΒΡΉœ…ΪΆ »ΞΘ§‘ρ÷ΛΟς¥φ‘ΎFe2ΘΪΓΘ“≤Ω…”ΟΧζ«ηΜ·ΦΊΘ§»ή“Κ≥ωœ÷»τάΕ…Ϊ≥ΝΒμΘ§‘ρ÷ΛΟςΚ§”–Fe2+ΘΜ
Ι ¥πΑΗΈΣΘΚΥα–‘KMnO4»ή“ΚΜρΧζ«ηΜ·ΦΊΓΘ

ΓΨΧβΡΩΓΩ―ΧΤχ(÷ς“ΣΈέ»ΨΈοSO2ΓΔNOX)Ψ≠O3‘Λ¥ΠάμΚσ”ΟCaSO3Υ°–ϋΗΓ“ΚΈϋ ’Θ§Ω…Φθ…Ό―ΧΤχ÷–ΒΡSO2ΓΔNOx ΒΡΚ§ΝΩΓΘ
(1) O3―θΜ·―ΧΤχ÷–SO2ΓΔNOx ΒΡ÷ς“ΣΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚ NO(g)ΘΪO3(g)![]() NO2(g)+ O2(g) ΠΛHΘΫΘ≠200.9 kJΓΛmol-13NO(g)ΘΪO3(g)
NO2(g)+ O2(g) ΠΛHΘΫΘ≠200.9 kJΓΛmol-13NO(g)ΘΪO3(g)![]() 3NO2(g) ΠΛHΘΫΘ≠317.3kJΓΛmol-1ΓΘ‘ρ2NO2(g)
3NO2(g) ΠΛHΘΫΘ≠317.3kJΓΛmol-1ΓΘ‘ρ2NO2(g)![]() 2NO(g)+O2(g)ΒΡΠΛHΘΫ_____________kJΓΛmol-1
2NO(g)+O2(g)ΒΡΠΛHΘΫ_____________kJΓΛmol-1
(2)TΓφ ±Θ§άϊ”Ο≤β―ΙΖ®‘ΎΗ’–‘Ζ¥”ΠΤς÷–Θ§ΆΕ»κ“ΜΕ®ΝΩΒΡNO2ΖΔ…ζΖ¥”Π3NO2(g)![]() 3NO(g)ΘΪO3(g)Θ§ΧεœΒΒΡΉή―Ι«Ω pΥφ ±Φδ tΒΡ±δΜ·»γœ¬±μΥυ ΨΘΚ
3NO(g)ΘΪO3(g)Θ§ΧεœΒΒΡΉή―Ι«Ω pΥφ ±Φδ tΒΡ±δΜ·»γœ¬±μΥυ ΨΘΚ
Ζ¥”Π ±Φδ/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
―Ι«Ω/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
ΔΌ»τΫΒΒΆΖ¥”ΠΈ¬Ε»Θ§‘ρΤΫΚβΚσΧεœΒ―Ι«Ω p______24.00 MPa(ΧνΓΑ>Γ±ΓΔΓΑ<Γ±ΜρΓΑΘΫΓ±),‘≠“ρ «____________ΓΘ
ΔΎ15min ±Θ§Ζ¥”ΠΈοΒΡΉΣΜ·¬ ΠΝ=______ΓΘ
ΔέTΓφ ±Ζ¥”Π3NO2(g)![]() 3NO(g)ΘΪO3(g)ΒΡΤΫΚβ≥Θ ΐKp=____________(Kp ΈΣ“‘Ζ÷―Ι±μ ΨΒΡΤΫΚβ≥Θ ΐΘ§Ζ÷―ΙΒ»”ΎΉή―Ι≥Υ“‘ΗΟΤχΧεΒΡΈο÷ ΒΡΝΩΖ÷ ΐ)
3NO(g)ΘΪO3(g)ΒΡΤΫΚβ≥Θ ΐKp=____________(Kp ΈΣ“‘Ζ÷―Ι±μ ΨΒΡΤΫΚβ≥Θ ΐΘ§Ζ÷―ΙΒ»”ΎΉή―Ι≥Υ“‘ΗΟΤχΧεΒΡΈο÷ ΒΡΝΩΖ÷ ΐ)
(3)TΓφ ±Θ§‘ΎΧεΜΐΈΣ2LΒΡΟή±’Η’–‘»ίΤς÷–Θ§ΆΕ»κ2 mol NO2ΖΔ…ζΖ¥”Π2NO2(g)![]() 2NO(g)ΘΪO2(g)Θ§ Β―ι≤βΒΟΘΚv’ΐ=k’ΐ c2(NO2)Θ§vΡφ=kΡφ c2(NO)ΓΛc(O2)Θ§k’ΐΓΔkΡφΈΣΥΌ¬ ≥Θ ΐΘ§ ήΈ¬Ε»”ΑœλΓΘ‘ΎΈ¬Ε»ΈΣTΓφ ±NO2ΒΡΉΣΜ·¬ Υφ ±Φδ±δΜ·ΒΡΫαΙϊ»γΆΦΥυ Ψ(Ζ¥”Π‘Ύ5.5min ±¥οΒΫΤΫΚβ)ΘΚ
2NO(g)ΘΪO2(g)Θ§ Β―ι≤βΒΟΘΚv’ΐ=k’ΐ c2(NO2)Θ§vΡφ=kΡφ c2(NO)ΓΛc(O2)Θ§k’ΐΓΔkΡφΈΣΥΌ¬ ≥Θ ΐΘ§ ήΈ¬Ε»”ΑœλΓΘ‘ΎΈ¬Ε»ΈΣTΓφ ±NO2ΒΡΉΣΜ·¬ Υφ ±Φδ±δΜ·ΒΡΫαΙϊ»γΆΦΥυ Ψ(Ζ¥”Π‘Ύ5.5min ±¥οΒΫΤΫΚβ)ΘΚ

ΔΌ‘ΎΧεΜΐ≤Μ±δΒΡΗ’–‘»ίΤς÷–Θ§ΆΕ»κΙΧΕ®ΝΩΒΡNO2ΖΔ…ζΖ¥”ΠΘ§“ΣΧαΗΏNO2ΉΣΜ·¬ Θ§Ω…≤…»ΓΒΡ¥κ © «______________ΓΔ___________ΓΘ
ΔΎ”…ΆΦ÷– ΐΨίΘ§«σ≥ωΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ_________ΓΘ
ΔέΦΤΥψA Βψ¥Πv’ΐ/vΡφ=_________________________(±ΘΝτ1ΈΜ–Γ ΐ)ΓΘ