题目内容
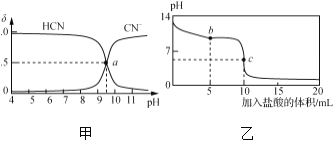
【题目】某学习小组的同学查阅相关资料知,氧化性:Cr2O72->Fe3+,设计了如图所示的盐桥原电池。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是
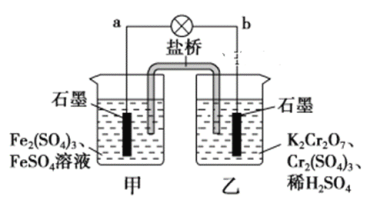
A. 甲烧杯的溶液中发生还原反应
B. 外电路的电流方向是从b到a
C. 电池工作时,盐桥中的SO42-移向乙烧杯
D. 乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-===Cr2O72-+14H+
【答案】B
【解析】
由于氧化性Cr2O72->Fe3+,即Cr2O72-可以将Fe2+氧化为Fe3+,故在原电池中,Fe2+失电子被氧化,故a极为负极;Cr2O72-得电子被还原,故b极为正极。
Fe2+失电子被氧化,即甲池发生氧化反应,A错误;外电路中电流由正极流向负极,即由b流向a,B正确;原电池中,阴离子移向负极,即SO42-移向甲烧杯,C错误;乙烧杯中Cr2O72-得电子被还原:Cr2O72-+6e-+14H+=2Cr3++7H2O,D错误。
故选B。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
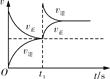
点睛新教材全能解读系列答案【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
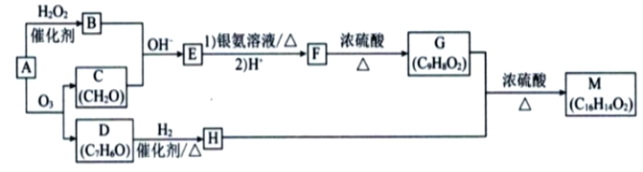
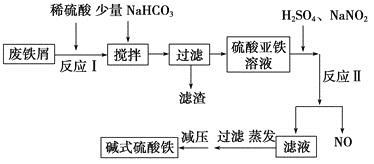
【题目】碱式硫酸铁[Fe(OH)SO4 ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH) 3 | Fe(OH) 2 | Al(OH) 3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3 的目的是调节溶液的pH,除去Al3+ ,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2 ,以减少NaNO2 的用量,O2 与NaNO2 在反应中均作__________。若参与反应的O2 有11.2 L(标准状况),则相当于节约NaNO2 的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+ 可部分水解生成Fe2(OH)42-,该水解反应的离子方程式为________________________________________________________________。 Fe(OH)3 的Ksp =____________。(提示,开始沉淀c(Fe 3+ )浓度为1.0×10 -5 mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+ 及NO3-。为检验所得的产品中是否含有Fe2+ ,应使用的试剂为________。