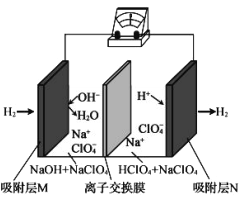
题目内容
【题目】N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.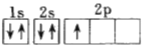
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
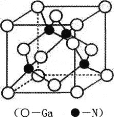
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______gcm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
【答案】A 2 2 N>O>S CO2(或CS2、COS) sp3杂化 NH3分子能形成氢键,而As电负性小,半径大,分子间不能形成氢键 共价 正四面体 ![]()
【解析】
(1)结合洪特规则及N原子序数判断;
(2)根据原子排布的构造原理,结合洪特规则,先写出S原子的核外电子排布式,可得知其核外未成对电子数,原子核外有几种能级,就有几种形状的电子云;
(3)根据电离能的变化规律比较不同元素的电离能大小,结合等电子体概念书写相应的等电子体;
(4)根据价层电子对互斥理论分析(CH3)3N的中性原子N原子的杂化;原子半径小,电负性大的元素的氢化物分子间可形成氢键;
(5)原子晶体中原子间通过共价键结合,根据晶胞中原子的空间排列判断与Ga连接的N原子构成的立体结构;用均摊法先计算一个晶胞中含有的N、Ga原子数目,然后根据晶体密度计算式计算该晶体密度大小。
(1)A.符合洪特规则,表示氮原子的最低能量状态,B、C项中2p的3个电子排布违背洪特规则,不是基态原子的电子排布,B、C错误;D.表示的是硼原子的基态核外电子排布,D错误;故合理选项是A;
(2)硫原子的核外电子排布为ls22s2p63s23p4,所以未成对电子有2个,硫原子核外电子只有2种能级,电子云形状只有2种;
(3)根据元素周期律,一般来说,同一周期的元素,从左到右,第一电离能呈增大的趋势,同一主族,从上到下,第一电离能呈减小的趋势,但若原子核外电子排布呈全空或半充满或全满结构更稳定,如第一电离能N>O,所以这三种元素的第一电离能由大到小关系为:N>O>S;原子数和价电子数均相同的微粒并具有相似的化学键特征称为等电子体,CO2或CS2、COS均是SCN-的等电子体。
(4) (CH3)3N可以看作三个甲基取代了NH3分子中的三个H原子而得,N原子含有的σ电子对为3,孤电子对数为![]() =1,所以N原子含有的电子对数为3+1=4,因此(CH3)3N分子中N原子采用sp3杂化; N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低。
=1,所以N原子含有的电子对数为3+1=4,因此(CH3)3N分子中N原子采用sp3杂化; N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低。
(5)金刚石是原子晶体,氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以共价键相结合。GaN的晶胞结构和金刚石类似,与同一个Ga原子相连的N原子构成的空间构型为正四面体。GaN晶体的密度为![]() 。
。

【题目】碱式硫酸铁[Fe(OH)SO4 ]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
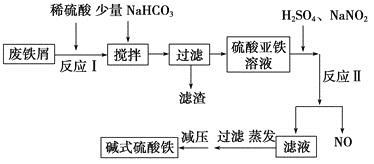
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH) 3 | Fe(OH) 2 | Al(OH) 3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3 的目的是调节溶液的pH,除去Al3+ ,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2 ,以减少NaNO2 的用量,O2 与NaNO2 在反应中均作__________。若参与反应的O2 有11.2 L(标准状况),则相当于节约NaNO2 的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+ 可部分水解生成Fe2(OH)42-,该水解反应的离子方程式为________________________________________________________________。 Fe(OH)3 的Ksp =____________。(提示,开始沉淀c(Fe 3+ )浓度为1.0×10 -5 mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+ 及NO3-。为检验所得的产品中是否含有Fe2+ ,应使用的试剂为________。
【题目】我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):

成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
含量 | 0.08 | 0.1 | 2.9~3.5 | 0.5 | 0.25~0.8 | 0.25 | 0.1 | 0.8~1.1 | Bal |
为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是______________________________。
(2)铝元素原子核外有_____种不同运动状态的电子,最外层电子排布式为___________。
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式_____________________________(写一个即可)。
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱_____________
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:______________________________________;写出其现象中的一个离子方程式_________________。
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D