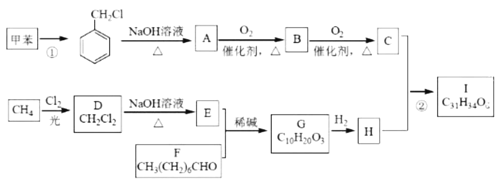
题目内容
【题目】(1)请写出惰性电极电解AgNO3溶液阳极的电极方程式_______________________。
(2)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
①常温下,某纯碱溶液中滴入酚酞,溶液呈红色,原因是______________________;(用离子方程式表示)
②常温下,在NH4Cl溶液中离子浓度由大到小的顺序为_____________________________;
③某温度时,水的离子积为KW=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为___________;
④室温下,0.1mol/L的酒石酸(H2C4H4O6)溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6)+2 c(C4H4O62)=__________mol/L。(用计算式表示)
⑤难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于__________;(该温度下Mg(OH)2的Ksp=2×1011)
【答案】4 OH - 4e=2 H2O+ O2↑或 2 H2O- 4e=4H++ O2↑ CO32+H2O![]() HCO3+OH c(Cl)>c(NH4+)>c(H+)>c(OH) 3或10 (0.05+10-6-10-8)mol/L) 10
HCO3+OH c(Cl)>c(NH4+)>c(H+)>c(OH) 3或10 (0.05+10-6-10-8)mol/L) 10
【解析】
(1)用惰性电极电解AgNO3溶液,阳极上水电离出的氢氧根离子失电子发生氧化反应生成氧气;
(2)①碳酸钠是强碱弱酸盐,碳酸根在溶液中水解使溶液呈碱性;
②氯化铵是强酸弱碱盐,常温下,铵根离子在溶液中水解使溶液呈酸性,一般情况下盐的水解程度都比较小;
③某温度时,水的离子积为KW=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,说明抑制水的电离,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,则该溶液可能是酸溶液,也可能是碱溶液;
④由酒石酸氢钠溶液中存在电荷守恒关系计算c(HC4H4O6)+2 c(C4H4O62);
⑤由Mg(OH)2的Ksp=c(Mg2+)c2(OH-)计算可得。
(1)用惰性电极电解AgNO3溶液,阳极上水电离出的氢氧根离子失电子发生氧化反应生成氧气,电极反应式为4OH--4e-=2H2O+O2↑或 2 H2O- 4e=4H++ O2↑,故答案为:4OH--4e-=2H2O+O2↑或 2 H2O- 4e=4H++ O2↑;
(2)①碳酸钠是强碱弱酸盐,碳酸根在溶液中水解使溶液呈碱性,滴入酚酞,溶液会变红色,水解的离子方程式为CO32+H2O![]() HCO3+OH,故答案为:CO32+H2O
HCO3+OH,故答案为:CO32+H2O![]() HCO3+OH;
HCO3+OH;
②氯化铵是强酸弱碱盐,常温下,铵根离子在溶液中水解使溶液呈酸性,一般情况下盐的水解程度都比较小,则溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为: c(Cl-)>c(NH4+)>c(H+)>c(OH-);
③某温度时,水的离子积为KW=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,说明抑制水的电离,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,则该溶液可能是酸溶液,也可能是碱溶液,若为酸溶液,溶液中c(H+)=![]() =
=![]() =1×10-3mol/L,溶液pH为3;若为碱溶液,溶液中c(OH-)=
=1×10-3mol/L,溶液pH为3;若为碱溶液,溶液中c(OH-)=![]() =
=![]() =1×10-3mol/L,溶液pH为10,故答案为:3或10;
=1×10-3mol/L,溶液pH为10,故答案为:3或10;
④由室温下,0.1mol/L的酒石酸(H2C4H4O6)溶液与pH=13的NaOH溶液等体积混合可知,酒石酸与氢氧化钠反应生成酒石酸氢钠,溶液的pH为6,说明酒石酸氢钠电离大于水解溶液呈酸性,酒石酸氢钠溶液中存在电荷守恒关系c(HC4H4O6)+2 c(C4H4O62)+ c(OH-)= c(Na+)+ c(H+),由电荷守恒关系可得c(HC4H4O6)+2 c(C4H4O62)= c(Na+)+ c(H+
⑤由Mg(OH)2的Ksp=c(Mg2+)c2(OH-)可知,c(OH-)=![]() =
=![]() =1×10-4mol/L,则溶液pH为10,故答案为:10。
=1×10-4mol/L,则溶液pH为10,故答案为:10。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
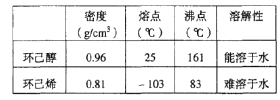
高效智能课时作业系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: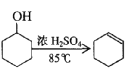 +H2O
+H2O
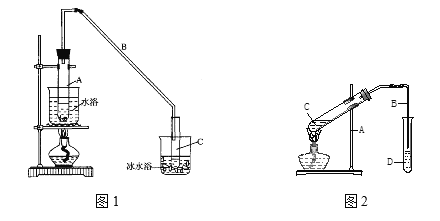
(1)如图1是实验室制取乙酸乙酯的装置。则下列说法不正确的是(____)
A.右边导管不插入饱和碳酸钠溶液
B.试管D中油状物在下层,饱和碳酸钠溶液主要为了中和挥发出的乙酸
C.试管C中加入试剂的顺序是:2mL浓硫酸→3mL乙醇→2mL冰醋酸
D.反应结束后试管C液体可能会变黑色
(2)在制取乙酸乙酯的过程中,用浓硫酸作为催化剂有缺点,不能重复使用,而且副反应较多。目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,6h C. 60℃,4h D.80℃,4h
(3)制备环己烯粗品(装置如图2)
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是_____________。
(4)制备环己烯精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),放液时,若发现液体流不出来,其可能原因除分液漏斗活塞堵塞外,还有________;分液后用_________ (填入编号)洗涤;
a.NaHSO4溶液 b.Na2CO3溶液 c.稀H2SO4 d.溴水
在此制备过程中,加入饱和食盐水的作用是__________________。
②对分离出来的环己烯再进行蒸馏得到环己烯精品,为了区分环己烯精品和粗品,某个小组设计了以下几种方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属K c.用Na2CO3溶液 d.用NaOH溶液
【题目】准确称量8.2g含有少量中性易溶杂质的烧碱样品,配成500mL待测溶液。用0.1000molL1的硫酸溶液进行中和滴定测定该烧碱样品的纯度,试根据试验回答下列问题:
(1)滴定过程中,眼睛应注视____________,若用酚酞作指示剂达到滴定终点的标志是____________。
(2)根据表数据,计算烧碱样品的纯度是_______________(用百分数表示,保留小数点后两位)
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL)) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果________。