��Ŀ����
����Ŀ��ʵ��������ͼ1Ϊʵ������ȡ����ʵ��װ�á�
��1��д��A����������Ӧ�Ļ�ѧ����ʽ____________________________________��
��2�����ռ���ʱ�Թܿ�����������______________________________________��
��3����һѧ������˼��������Ȫ�����������������ͼ3װ�á���������ƿ�зֱ�����������������ʣ���Ӧ�������Ȫ������____��
A��CaCO3��ĩ��Ũ���� B��п����ϡ���� C��ϡ�����AgNO3��Һ
��4����ͬѧ������ƿ�м���ƾ���ˮ���м�����ˮ���ټ����������������ʣ����Ҳ��������Ȫ��ˮ���м�������ʿ�������____��
A����ʯ�� B��ʳ�� C��Ũ����
ʵ������Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ���������Ѽ���)��
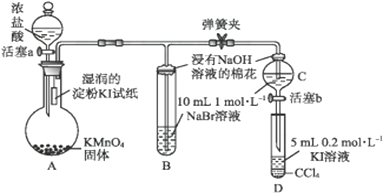
ʵ����̣�
�������ɼУ�����a���μ�Ũ���ᡣ
������B��C�е���Һ����Ϊ�Ȼ�ɫʱ���н����ɼС�
������B�гȻ�ɫ��Һ��ɫ����ʱ���رջ���a��
��. ����b��������C����Һ����D�У��رջ���b��ȡ��D��
��1��A�в�������ɫ���壬�仯ѧ����ʽ��__________________
��2��B����Һ������Ӧ�����ӷ���ʽ��____________________
��3����������Ŀ��Ϊ______________
��4��D�г��ֵ�����Ϊ____________________________
��5���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ���_______���õ�������������
���𰸡� 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O ����������Ķ�������֤�Թ������ռ������� AB AC 16HCl(Ũ)+2KMnO4===2MnCl2+2KCl+5Cl2��+8H2O Cl2+2Br===Br2+2Cl Ϊ��֤���������ǿ�ڵ� ��Һ���ú�CCl4����Һ��Ϊ�Ϻ�ɫ ԭ�Ӱ뾶������
CaCl2��2NH3����2H2O ����������Ķ�������֤�Թ������ռ������� AB AC 16HCl(Ũ)+2KMnO4===2MnCl2+2KCl+5Cl2��+8H2O Cl2+2Br===Br2+2Cl Ϊ��֤���������ǿ�ڵ� ��Һ���ú�CCl4����Һ��Ϊ�Ϻ�ɫ ԭ�Ӱ뾶������
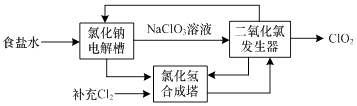
��������������1�����õ��ǹ�+�̻�ϼ��������ķ���,�����Ȼ�狀��������ƹ����ϼ�����![]() ,�Ȼ�����������Ʒ�Ӧ�����Ȼ��ơ�������ˮ,��Ӧ�Ļ�ѧ����ʽΪ: (1). 2NH4Cl��Ca(OH)2
,�Ȼ�����������Ʒ�Ӧ�����Ȼ��ơ�������ˮ,��Ӧ�Ļ�ѧ����ʽΪ: (1). 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O ����ȷ����2NH4Cl��Ca(OH)2
CaCl2��2NH3����2H2O ����ȷ����2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O��
CaCl2��2NH3����2H2O��
��2���ռ������õ��������ſ�����,�Թܿ����������Ǽ��ٰ���������Ķ���,�ӿ��ռ�������,ͬʱ��֤�Թ������ռ�����������ȷ��������������Ķ�������֤�Թ������ռ���������
��3��CaCO3��ĩ��Ũ���ᷴӦ��������������̼,ʹ��ƿ��ѹǿ����,�γ���Ȫ,A��ȷ��п��ϡ���ᷴӦ������������������ʹ��ƿ��ѹǿ����,�γ���Ȫ, B��ȷ��HCl�� AgNO3��Һ��Һ,����������,�����γ���Ȫ,C������ȷѡ��AB��
��4����ƿ��װ�оƾ�,�ӷ�,Ҫ�γ���Ȫ,Ӧʹ��ƿ��ѹǿ����,��������Ӧ�ų���������,Ũ������ˮ��ϡ��,�ͷų���������,ʹ��ƿ�е��Ҵ��ӷ�,ѹǿ����,�γ���Ȫ,��ʯ������ˮ�ų�����������ʹ��ƿ�е��Ҵ��ӷ�,ѹǿ����,�γ���Ȫ����ʳ������ˮ�ﲻ�ܷų���������,���ܲ�����Ȫ����ȷѡ��AC��
��1��A�и��������Ũ���ᷴӦ��������������ɫ�����Ȼ������Ȼ��غ�ˮ����ѧ����ʽ����16HCl(Ũ)+2KMnO4===2MnCl2+2KCl+5Cl2��+8H2O����ȷ����16HCl(Ũ)+2KMnO4===2MnCl2+2KCl+5Cl2��+8H2O��
��2�������������Դ����壬��������ܹ����������ӱ�Ϊ�嵥�ʣ����ӷ���ʽ�ǣ�Cl2+2Br===Br2+2Cl ����ȷ����Cl2+2Br===Br2+2Cl ��
��3��C��NaBr��������Ӧ����NaCl��Br2����C����Һ����D�У���������Ӧ��Br2��2KI===I2��2KBr�����ú�D����Һ�ֲ㣬�²�Ϊ������Ȼ�̼��Һ�����Ϻ�ɫ������˵�����������ǿ�ڵ⣻��ȷ�𰸣�Ϊ��֤���������ǿ�ڵ⡣
��4��D�����û����⣬�����������Ȼ�̼�����ܶȴ���ˮ�����²㣬��Һ���ú�CCl4����Һ��Ϊ�Ϻ�ɫ����ȷ�𰸣���Һ���ú�CCl4����Һ��Ϊ�Ϻ�ɫ��
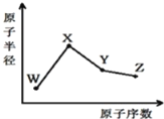
��5���ȡ��塢�ⵥ�ʵ�����������������Ϊ��Cl��I��ԭ�Ӱ뾶�����õ���������������ȷ����ԭ�Ӱ뾶������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�