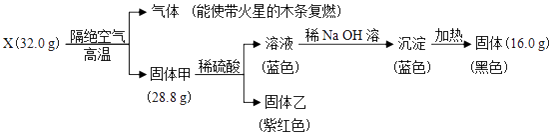
��Ŀ����
����Ŀ��������AX3�͵���X2��һ�������·�Ӧ�����ɻ�����AX5 �� �ش��������⣮
��1����֪AX3���۵�ͷе�ֱ�Ϊ��93.6���76�棬AX5���۵�Ϊ167�森����ʱAX3������X2��Ӧ����lmol AX5 �� �ų�����123.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
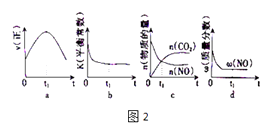
��2����ӦAX3��g��+X2��g��AX5��g�����ݻ�Ϊ10L���ܱ������н��У���ʼʱAX3��X2��Ϊ0.2mol����Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��
�����в���˵����Ӧ�ﵽƽ��״̬���� ��
A����������ƽ����Է����������ֲ���
B����������ܶȱ��ֲ���
C����ϵ��X2������������ֲ���
D��ÿ����1molAX3ͬʱ����1molAX5
�ڼ���ʵ��a�ӷ�Ӧ��ʼ���ﵽƽ��ʱ�ķ�Ӧ����v��AX5��=������2λ��Ч���֣���
��ͼ��3��ʵ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ�ķ�Ӧ����v��AX5���ɴ�С�Ĵ���Ϊ����ʵ����ţ�����ʵ��a��ȣ���������ı��ʵ���������ж������ǣ�b��c �� �÷�Ӧ��ʵ��a��ʵ��c�еĻ�ѧƽ�ⳣ���Ĵ�С��ϵ��KaKc�����������=����������Kc=������С�����1λ����
���𰸡�
��1��AX3��l��+X2��g��=AX5��s����H=��123.8kJ?mol��1
��2��B��0.00017mol/��L?min����b��c��a����������������¶ȣ�����55.6L/mol
���������⣺��1����ΪAX3���۵�ͷе�ֱ�Ϊ��93.6���76�棬AX5���۵�Ϊ167�棬������ʱ��AX3ΪҺ̬��AX5Ϊ��̬������1mol AX5 �� �ų�����123.8kJ���÷�Ӧ���Ȼ�ѧ����Ϊ��AX3��l��+X2��g��=AX5��s����H=��123.8kJmol��1 �� ���Դ��ǣ�AX3��l��+X2��g��=AX5��s����H=��123.8kJmol��1����2����A������������������䣬�淴Ӧ���������ʵ�������ƽ����Է���������С����������ƽ����Է����������ֲ��䣬˵����Ӧ����ƽ�⣬��A��ȷ�� B������������������䣬����������䣬��������ܶ�ʼ�ձ��ֲ��䣬����˵������ƽ�⣬��B���� C��X2������������ֲ��䣬˵������ƽ�⣬��C��ȷ�� D��ÿ����1mol AX3��ͬʱ����1mol AX5 �� ������1mol AX5��ͬʱ����1molAX3 �� AX3����������������������ȣ���Ӧ����ƽ�⣬��D��ȷ����ѡ��B������ͼ��֪��ʵ��a��60minʱ����ƽ�⣬ƽ��ʱAX3�Ħ�=2��1�� ![]() ��=2����1��
��=2����1�� ![]() ��=50%����μӷ�ӦAX3�����ʵ���Ϊ0.2mol��50%=0.1mol���ɷ���ʽ��֪����AX5�����ʵ���Ϊ0.1mol����v��AX5��=
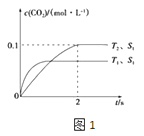
��=50%����μӷ�ӦAX3�����ʵ���Ϊ0.2mol��50%=0.1mol���ɷ���ʽ��֪����AX5�����ʵ���Ϊ0.1mol����v��AX5��= ![]() =0.00017mol/��Lmin �������Դ��ǣ�0.00017mol/��Lmin ���������ں��º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ�����ͬʱ����ѹǿ�仯��Խ��Ӧ����Խ�죬��ͼ��֪���ӿ�ʼ��ƽ��ʱa��b��cѹǿ�ֱ�Ϊ40kPa��40kPa��35kPa������ʱ��ֱ�Ϊ60min��40min��45min��ÿ������ѹǿƽ���仯�ֱ�Ϊ
=0.00017mol/��Lmin �������Դ��ǣ�0.00017mol/��Lmin ���������ں��º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ�����ͬʱ����ѹǿ�仯��Խ��Ӧ����Խ�죬��ͼ��֪���ӿ�ʼ��ƽ��ʱa��b��cѹǿ�ֱ�Ϊ40kPa��40kPa��35kPa������ʱ��ֱ�Ϊ60min��40min��45min��ÿ������ѹǿƽ���仯�ֱ�Ϊ ![]() Pa��
Pa�� ![]() Pa��
Pa�� ![]() Pa���ʷ�Ӧ����b��c��a��ʵ��a��b��ȣ���ʼѹǿ��ȣ�ƽ��ʱѹǿ���䣬�ı�������Ӱ��ƽ���ƶ�����b����ƽ���ʱ��϶̣���Ӧ���ʽϿ죬���ڷ�Ӧ��������������С��bӦ��ʹ�ô����� a��c���c��ķ�Ӧ���ʼӿ죬ƽ��ʱc��ѹǿ�仯��Խ�С��˵����a��ȣ�ƽ�������ƶ���˵�����¶����ߣ�����ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С����c����¶ȸ���a�飬��ƽ�ⳣ��Ka��Kc�� c��ƽ��ʱ��AX3��ƽ��ת���ʦ�cΪ40%��ƽ�ⳣ��K=
Pa���ʷ�Ӧ����b��c��a��ʵ��a��b��ȣ���ʼѹǿ��ȣ�ƽ��ʱѹǿ���䣬�ı�������Ӱ��ƽ���ƶ�����b����ƽ���ʱ��϶̣���Ӧ���ʽϿ죬���ڷ�Ӧ��������������С��bӦ��ʹ�ô����� a��c���c��ķ�Ӧ���ʼӿ죬ƽ��ʱc��ѹǿ�仯��Խ�С��˵����a��ȣ�ƽ�������ƶ���˵�����¶����ߣ�����ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С����c����¶ȸ���a�飬��ƽ�ⳣ��Ka��Kc�� c��ƽ��ʱ��AX3��ƽ��ת���ʦ�cΪ40%��ƽ�ⳣ��K= ![]() =
= ![]() ��V=��
��V=�� ![]() ��10��L/mol=��
��10��L/mol=�� ![]() ��10��L/mol=55.6L/mol�����Դ��ǣ�b��c��a����������������¶ȣ�����55.6L/mol��
��10��L/mol=55.6L/mol�����Դ��ǣ�b��c��a����������������¶ȣ�����55.6L/mol��
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

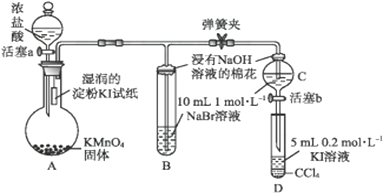
����Ŀ��ʵ�����Ʊ�1��2����������ķ�Ӧԭ�����£�
CH3CH2OH ![]() CH2�TCH2
CH2�TCH2
CH2�TCH2+Br2��BrCH2CH2Br
���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѣ�������������������Ҵ��Ʊ�1��2�����������װ����ͼ��ʾ��
�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | һl30 | 9 | ��1l6 |
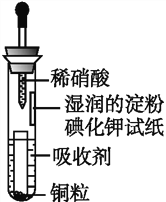
�ش��������⣺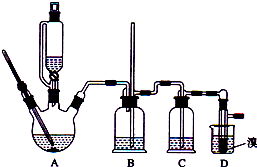
��1���ڴ��Ƹ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ������������ȷѡ��ǰ����ĸ��
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��2����װ��C��Ӧ���� �� ��Ŀ�������շ�Ӧ�п������ɵ��������壺������ȷѡ��ǰ����ĸ��
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��3���жϸ��Ʊ���Ӧ�Ѿ����������������
��4����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ���㣨��ϡ������¡�����
��5����������������δ��Ӧ��Br2 �� �����ϴ�ӳ�ȥ��������ȷѡ��ǰ����ĸ��
a��ˮ b������������Һ c���⻯����Һ d���Ҵ�
��6�������������������������ѣ������ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ���� ��