题目内容
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 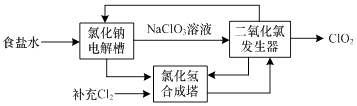
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
【答案】
(1)2Fe3++SO2+2H2O=2Fe2++SO4 2﹣+4H+
(2)3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑
(3)Cl﹣+3H2O ![]() ClO3﹣+3H2↑;
ClO3﹣+3H2↑;![]() ;2ClO2+2CN﹣=2CO2↑+2Cl﹣+N2↑
;2ClO2+2CN﹣=2CO2↑+2Cl﹣+N2↑
【解析】解:(1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO4 2﹣+4H+ , 所以答案是:2Fe3++SO2+2H2O=2Fe2++SO4 2﹣+4H+;(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液,若溶液的pH偏高,溶液碱性增强,铝离子与碳酸根离子双水解生成氢氧化铝和二氧化碳,反应的化学方程式为3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑,
所以答案是:3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑;(3)根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2 , 可以写出方程式,并用化合价升降法配平得到,ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl﹣ , 根据电荷守恒和元素守恒写出该反应的离子方程式,①电解食盐水得到氯酸钠(NaClO3)和H2 , 电解的离子反应方程式为:Cl﹣+3H2O ![]() ClO3﹣+3H2↑,所以答案是:Cl﹣+3H2O
ClO3﹣+3H2↑,所以答案是:Cl﹣+3H2O ![]() ClO3﹣+3H2↑;
ClO3﹣+3H2↑;
②ClO2发生器中的反应为,化学方程式NaClO3和盐酸发生歧化反应,生成NaCl、ClO2、Cl2、H2O,用化学方程式表示并标出电子转移的方向及数目为 ![]() ,
,
所以答案是: ![]() ;③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl﹣ , 反应的离子方程式为 2ClO2+2CN﹣=2CO2↑+2Cl﹣+N2↑,
;③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl﹣ , 反应的离子方程式为 2ClO2+2CN﹣=2CO2↑+2Cl﹣+N2↑,
所以答案是:2ClO2+2CN﹣=2CO2↑+2Cl﹣+N2↑.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案