题目内容
(14分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________ __,该元素的符号是_________。
(2)Y元素原子的价电子的轨道表示式为__ __,该元素的名称是__________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为___ _________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_____________________________________。
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低________________________。(用分子式表示)
(1)X元素原子基态时的电子排布式为________ __,该元素的符号是_________。
(2)Y元素原子的价电子的轨道表示式为__ __,该元素的名称是__________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为___ _________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_____________________________________。
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低________________________。(用分子式表示)
(1)1s22s22p63s23p63d104s24p3(2分) As(1分)
(2)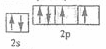 或
或 (2分)氧(1分)
(2分)氧(1分)
(3)三角锥形(1分)
(4)As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O(2分)
(5)稳定性:NH3 > PH3 > AsH3 ,( 2分)因为键长越短,键能越大,化合物稳定(2分)
(2)
 或
或 (2分)氧(1分)
(2分)氧(1分)(3)三角锥形(1分)
(4)As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O(2分)
(5)稳定性:NH3 > PH3 > AsH3 ,( 2分)因为键长越短,键能越大,化合物稳定(2分)
由题意可各X元素为As(砷)、Y元素为O元素、Z元素为H元素;所以
(1) As元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3;
(2) O元素原子的价电子的轨道表示式为 或
或 ;
;
(3) X与Z可形成化合物XZ3为AsH3;空间构型为三角锥形;
(4) X2Y3的化学式为As2O3;所以该反应的方程式为;As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O
(5) X的氢化物为AsH3,同族第二周期元素的氢化为NH3、第三周期氢化物为PH3,由于NH3分子间存在氢键,使其沸点高于同族的其他氢化物,所以,稳定性:NH3 > PH3 > AsH3 ;
(1) As元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3;
(2) O元素原子的价电子的轨道表示式为
 或
或 ;
;(3) X与Z可形成化合物XZ3为AsH3;空间构型为三角锥形;
(4) X2Y3的化学式为As2O3;所以该反应的方程式为;As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O
(5) X的氢化物为AsH3,同族第二周期元素的氢化为NH3、第三周期氢化物为PH3,由于NH3分子间存在氢键,使其沸点高于同族的其他氢化物,所以,稳定性:NH3 > PH3 > AsH3 ;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。 He。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列关于
He。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列关于