题目内容
(7分)下表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
(1)①-⑧中金属性最强的元素是(元素符号)___________。
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________________。
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______________。
(4)由②和④组成的化合物与⑥单质反应的化学方程式为_________________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | | | | |
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________________。
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______________。
(4)由②和④组成的化合物与⑥单质反应的化学方程式为_________________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(7分)
(1)Na(1分)(2)Na>Al>O (1分) (3)HNO3>H2CO3>H2SiO3(H4SiO4)(1分)

(1)Na(1分)(2)Na>Al>O (1分) (3)HNO3>H2CO3>H2SiO3(H4SiO4)(1分)

同周期从左到右元素的金属性减弱,同主族从上到下元素的金属性增强,即⑤为Na元素,金属性最强;同周期从左到右元素原子半径减小,同主族从上到下,元素原子半径增大,即可得Na>Al>O;比较元素的最高价含氧酸的酸性即比较非金属元素的非金属强弱,可得HNO3>H2CO3>H2SiO3(H4SiO4);由②和④组成的化合物与⑥单质反应的化学方程式为: ;⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为
;⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为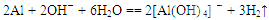
 ;⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为
;⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为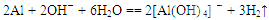

练习册系列答案
相关题目