题目内容
19.已知下列反应:2FeCl2+Cl2═2FeCl3;2FeCl3+2KI═2FeCl2+2KCl+I2,下列判断正确的是( )| A. | 氧化性Cl2>Fe3+>I2 | B. | 还原性 Fe2+>Cl->I- | ||
| C. | 氧化性Fe3+>Cl2>I2 | D. | 还原性 Fe2+>I->Cl- |
分析 根据反应方程式进行比较:氧化剂+还原剂=还原产物+氧化产物,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物,据此分析.
解答 解:根据2FeCl2+Cl2═2FeCl3可知,氧化剂Cl2、氧化产物为FeCl3、还原剂FeCl2、还原产物为2FeCl3,所以氧化性:Cl2>FeCl3,还原性为:FeCl2>FeCl3,根据2FeCl3+2KI═2FeCl2+2KCl+I2可知,氧化剂为FeCl3、还原剂为KI、还原产物为FeCl2、氧化产物为I2,所以氧化性:FeCl3>I2,还原性为:KI>FeCl2.故氧化性顺序为:Cl2>FeCl3>I2,即Cl2>Fe3+>I2,还原性顺序为:KI>FeCl2>FeCl3,即I->Fe2+>Cl-,故选A.
点评 本题考察了根据方程式来比较氧化性和还原性.解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物.

练习册系列答案
相关题目
4.0.3mol O2和0.2mol O3,下列量相等的是( )
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
10. 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| B. | Ⅱ中的澄清石灰水变浑浊 | |
| C. | Ⅲ中紫色石蕊试液变红 | |
| D. | 鸡蛋壳发生了分解反应 |
7.乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平.结合图1路线回答:
已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)写出A的电子式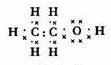 .
.
(2)反应Ⅱ的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是 .
.
(4)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是3mL和4mol•L-1.
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)写出A的电子式
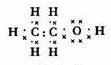 .
.(2)反应Ⅱ的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(4)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

14.某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应2Al+3Cu2+=2Al3++3Cu;化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放在b上,不能直接放在桌面上.实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的氯化铜溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应2Al+3Cu2+=2Al3++3Cu;化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+.该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程如图所示:

①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于c上(用以下所给仪器的编号填入,下同),取用坩埚应使用e,灼烧后的坩埚应放在b上,不能直接放在桌面上.实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热蒸发、冷却结晶、过滤洗涤、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:产生等量胆矾途径Ⅱ消耗硫酸少、途径Ⅱ不会产生污染大气的气体.
4.Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是( )
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子2 mol | |
| C. | Na2O2只作氧化剂 | |
| D. | Na2O2只作还原剂 |
8.关于氨水的叙述中错误的是( )
| A. | 氨水的主要成分是NH3•H2O | |
| B. | 氨水可使酚酞指示剂变红 | |
| C. | 氨水中含三种分子和两种离子 | |
| D. | 氨水中溶质的质量分数越大,溶液密度越小 |
9.若某原子的摩尔质量是M g•mol-1,则一个该原子的实际质量是( )
| A. | M g | B. | $\frac{1}{M}$ g | C. | $\frac{M}{6.02×1{0}^{23}}$ g | D. | $\frac{6.02×1{0}^{23}}{M}$g |