题目内容
15.把2.5molA和2.5molB混合盛入2L容积的密闭容器里发生反应:3A(g)+B(g)?x C(g)+2D(g),经5s后反应达平衡.在此5s内C的平均反应速率为0.2mol•L-1•s-1,同时生成1molD.试求:(1)x的值=4;
(2)达平衡时B的转化率是20%;
(3)若达平衡时,该反应放出QkJ的热量,写出该反应的热化学方程式:3A(g)+B(g)?4C(g)+2D(g)△H=-2QkJ•mol-1;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是2.4L.
(5)已知:CO(g)+NO2(g)≒CO2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅下列关于该反应的说法正确的是ACDF
A.该反应为放热反应 B.降温后CO的浓度增大
C.降温后NO2的转化率增加 D.降温后NO的体积分数增大
E.增大压强混合气体的颜色不变
F.恒容时,通入He气体,混合气体颜色不变
G.恒压时,通入He气体,混合气体颜色不变.
分析 依据化学平衡三段式列式计算,5s内C的平均反应速率为0.2mol•L-1•s-1,生成C物质的量=0.2mol•L-1•s-1×2L×5s=2mol,生成D为1mol,
3A(g)+B(g)?x C(g)+2D(g)
起始量(mol) 2.5 2.5 0 0
变化量(mol) 1.5 0.5 0.5x 1
平衡量(mol) 1 2 0.5x 1
0.5x=2mol,x=4
(1)依据计算得到x值;
(2)转化率=$\frac{消耗量}{起始量}$×100%;
(3)依据平衡时消耗B物质的量0.5mol,反应放热Q kJ的热量,消耗1mol放热2QKJ,结合热化学方程式书写,标注物质聚集状态和对应焓变;
(4)计算反应后混合气体的物质的量之和,恒温恒压下,体积之比之比等于物质的量之比,据此计算;
(5)CO(g)+NO2(g)?CO2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅说明平衡正向进行,正反应为放热反应;结合化学平衡移动原理分析选项判断;
解答 解:(1)5s内C的平均反应速率为0.2mol•L-1•s-1,同时生成1molD,故生成的C的物质的量为5s×0.2mol•L-1•s-1×2L=2mol,化学计量数之比等于物质的量之比,故x:2=2mol:1mol,解得x=4,
故答案为:4;
(2)由方程式3A(g)+B(g)?4C(g)+2D(g)可知,参加反应的B的物质的量为1mol×$\frac{1}{2}$=0.5mol,故B的转化率为$\frac{0.5mol}{2.5mol}$×100%=20%,
故答案为:20%;
(3)0.5molB反应放出的热量为QkJ,故1molB反应放出的热量为QkJ×$\frac{1mol}{0.5mol}$=2QkJ,故该反应的热化学方程式为3A(g)+B(g)?4 C(g)+2D(g)△H=-2Q kJ•mol-1,
故答案为:3A(g)+B(g)?4 C(g)+2D(g)△H=-2Q kJ•mol-1;
(4)反应生成1molD,则:
3A(g)+B(g)?4 C(g)+2D(g) 气体物质的量增大△n
2 2
1mol 1mol
故平衡时混合气体的物质的量为2.5mol+2.5mol+1mol=6mol,恒温恒压下,体积之比之比等于物质的量之比,令平衡时的体积为V,则5mol:6mol=2L:V,解得V=2.4L,
故答案为:2.4L;
(5)已知:CO(g)+NO2(g)?CO2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅下列关于该反应的说法正确的是
A.降低温度,混合物的颜色变浅,说明平衡正向进行,该反应为放热反应,故A正确;
B.降温后平衡正向进行,CO的浓度减小,故B错误;
C.降温后平衡正向进行,NO2的转化率增加,故C正确;
D.降温后平衡正向进行,NO的体积分数增大,故D正确;
E.反应是气体体积不变的反应,增大压强平衡不动,但物质浓度增大混合气体的颜色变深,故E错误;
F.恒容时,通入He气体,总压增大,分压不变,平衡不动,混合气体颜色不变,故F正确;
G.恒压时,通入He气体,为保持恒压,体积增大,混合气体颜色变浅,故G错误;
故答案为:ACDF.
点评 本题考查化学平衡的有关计算,平衡影响因素分析判断,难度中等,注意(3)中热化学方程式的书写的关键是计算反应热,(4)中气体体积比等于气体 物质的量之比,题目难度中等.

请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{3}(H{\;}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
| A. | 氧化还原反应的本质是电子发生转移 | |
| B. | 含化合价升高元素的反应物被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 2O3═3O2,不属于氧化还原反应 |
| A. | 4p2表示4p能级有2个轨道 | |
| B. | 水、氨气、甲烷的键角依次减小 | |
| C. | 原子序数为14、15、35的元素位于周期表的P区 | |
| D. | 分子中键长越短、键能越大,则分子越稳定 |
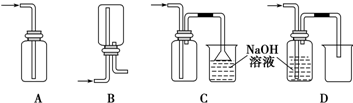
(1)下列收集Cl2的正确装置是C.
(2)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是Cl2;HClO.
(3)设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,逐渐滴加NaBr溶液,振荡静置,液体分层,下层溶液呈橙红色.
(二)某学生对SO2与漂粉精(漂白粉)的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
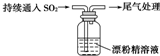 A | ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)用离子方程式解释漂粉精溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性;漂白性.
(4)将A瓶中混合物过滤、洗涤,得到沉淀X,向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4.
 取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,
取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,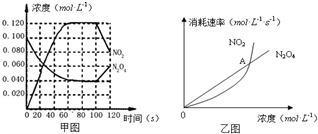 100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+57.0kJ•mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+57.0kJ•mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示,