题目内容
3.下列反应的离子(或化学)方程式正确的是( )| A. | 用不活泼金属铜作电极电解饱和食盐水:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | HCO3-离子水解方程式:HCO3-+H2O═H3O++CO32- | |
| C. | 乙烯通入溴水中:C2H4+Br2═CH2BrCH2Br | |
| D. | 氯化铁溶液与碳酸氢钠溶液混合:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ |
分析 A.金属铜作电极,阳极Cu失去电子;
B.HCO3-离子水解生成碳酸;
C.发生加成反应,有机反应中不用“═”;
D.相互促进水解生成沉淀和气体.
解答 解:A.用不活泼金属铜作电极电解饱和食盐水的离子反应为Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cu(OH)2↓,故A错误;
B.HCO3-离子水解方程式为HCO3-+H2O?OH-+H2CO3,故B错误;
C.乙烯通入溴水中发生加成反应为CH2=CH2+Br2→CH2BrCH2Br,故C错误;
D.氯化铁溶液与碳酸氢钠溶液混合的离子反应为Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电解、水解及有机反应的考查,综合性较强,题目难度不大.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
13.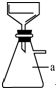 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
已知ZnSO4的溶解度如下表所示:
(1)实验过程中多次用到如图所示的过滤装置,仪器a的名称为抽滤瓶.
(2)滤渣Ⅰ的主要成分为PbSO4.X的化学式为ZnO或Zn(OH)2.
(3)溶解过程中加入的稀硫酸的作用是制备ZnSO4并抑制ZnSO4水解.
(4)结晶的操作为蒸发浓缩、冷却结晶.
(5)用酒精进行洗涤的原因是减少硫酸锌晶体的损失,容易干燥.
 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
已知ZnSO4的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
(2)滤渣Ⅰ的主要成分为PbSO4.X的化学式为ZnO或Zn(OH)2.
(3)溶解过程中加入的稀硫酸的作用是制备ZnSO4并抑制ZnSO4水解.
(4)结晶的操作为蒸发浓缩、冷却结晶.
(5)用酒精进行洗涤的原因是减少硫酸锌晶体的损失,容易干燥.
18.向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1.
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
15.25℃时,下列有关CH3COOH和CH3COONa溶液关系正确的是( )
| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
12. 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 从反应开始到平衡,氢气的平均反应速率为0.225mol•L-1•min-1 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
13.已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应水化物酸性依次增强,下列判断正确的是( )
| A. | 最高化合价按X、Y、Z的顺序减小 | B. | 阴离子的还原性按X、Y、Z顺序增强 | ||
| C. | 单质的氧化性按X、Y、Z顺序增强 | D. | 氢化物的稳定性按X、Y、Z顺序减小 |
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: