题目内容
【题目】如图两瓶体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是

A.原子数相等
B.密度相等
C.质量相等
D.质子数相等
【答案】A
【解析】
同温同压下,相同体积的任何气体具有相同物质的量,结合氮气、氧气和NO都是双原子分子分析。
根据阿伏加德罗定律可知,体积相等的气体在同温同压时具有相同物质的量;
A. N2、O2、NO都是双原子分子,根据N=nNA可知两瓶内气体具有相同原子数,故A正确;
B. 两瓶气体的质量不确定,则无法确定两瓶气体的密度是否相等,故B错误;
C. 氮气和氧气的比例不确定,无法判断两瓶气体的质量是否相等,故C错误;
D. 两瓶体积相等的气体,在同温、同压下物质的量相同,氮气和氧气的比例不确定,无法确定质子数是否相同,故D错误;
答案选A。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝 |
②中溶液产生胶状沉淀 | |
③中生成沉淀 | |
④中产生黄绿色气体 |
下列分析不正确的是
A. ①中溶液变蓝,体现了浓盐酸的氧化性
B. ②中产生白色胶状沉淀:2H++SiO32-=H2SiO3
C. ③中产生沉淀的原因可用平衡移动原理解释
D. ④中产生黄绿色气体:ClO-+Cl-+2H+=Cl2↑+H2O
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)![]()
![]()
![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)右图表示NO2的变化的曲线是_______。用O2表示从0~2 s内该反应的平均速率v=_______________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
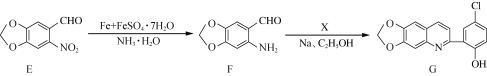
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________________________。
(2)该反应的离子方程式为_____________________。
(3)(NH4)2S2O8可视为由两分子琉酸缩合所得,若硫酸的结构简式为 ,则H2S2O8的结构简式为 ________________。
,则H2S2O8的结构简式为 ________________。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。

已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5mol L-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为________________________。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为__________。“还原”时发生的置换反应在化学上又叫作__________。