��Ŀ����
����Ŀ����ҵ����ľ̿�ۺ�ˮ�����ڸ��������·�Ӧ��ȡH2��ͬʱ����CO2��ijѧϰС����ʵ ������ģ��H2�Ĺ�ҵ�������̲��ⶨ����ʣ�ʵ��װ��������ʾ��

��1������a������Ϊ_______________������b������Ϊ____________________________��
��2��ʵ�鲽�裺���Ӻ�װ�ã����װ�õ������ԣ�______________________����˳���������в������ţ���
����װ��A��B��C��D�зֱ������Ӧ�Լ�������K��ͨ��һ��ʱ��N2��
�ڼ���װ��B��Ӳ�ʲ����ܡ�
�۹رջ���K������ʢ������ˮ�������ܡ�
�ܵ�ȼװ��A���ƾ��ơ�
�ݴ�װ��B��ľ̿����ȫ��Ӧ��ֹͣ���ȡ�
��3��װ��B��Ӳ�ʲ������з��������з�Ӧ�Ļ�ѧ����ʽΪ______________________��
��4����ȡB���ܶ���ʱ��Ӧע�������Ϊ��ȴ�����¡�___________�������밼Һ����͵����У������Ӷ�ȡ��ʼ����������������������___________���ƫ��ƫС������
��5��ʵ�������ȡ���������ΪV2 mL��״������ȡװ��C��Һ�壬��������BaCl2��Һ�����ˡ�ϴ�ӣ�����Һ��ϴ��Һ�ϲ����Լ���Ϊָʾ������0.1000molL-1���������Һ�ζ����ﵽ�ζ��յ�ʱ�����ı���Һ�����ΪV3mL��
�ٴﵽ�ζ��յ�ʱ������Ϊ____________________________________________��
��H2�IJ���Ϊ______________________���г�����ʽ���ɣ���
�ۻ���ͨ��___________���ó�װ��C�������ղ�������ʵ�����
��6���Ӱ�ȫ�Ƕȿ��ǣ���ʵ��װ�õ�ȱ��Ϊ_________________________________��
���𰸡��ƾ���� ƽ��ѹǿ�����װ���Ƿ���ڶ��� �٢ۢڢܢ� C+H2O��g��![]() CO+H2��C+2H2O��g��
CO+H2��C+2H2O��g��![]() CO2+2H2 ����������������Һ����ƽ ƫ�� ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ
CO2+2H2 ����������������Һ����ƽ ƫ�� ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ  �ⶨϴ��������BaCO3������ ȱ�ٷ�����װ��
�ⶨϴ��������BaCO3������ ȱ�ٷ�����װ��
��������
ģ��H2�Ĺ�ҵ�������̣�ľ̿��ˮ������Ӧ��Aװ���ṩˮ��������B����ľ̿��Ӧ���ɶ�����̼��������C��NaOH��Һ����CO2��Dװ�ø��E��ˮ�����������ڲ���ʡ�
��1����װ��ͼ![]() ֪����a������Ϊ�ƾ���ơ���������b��������ѹ��ͨ����ƽ��ѹǿ�������װ���Ƿ���ڶ�������Ϊ�ƾ����ƽ��ѹǿ�����װ���Ƿ���ڶ�����
֪����a������Ϊ�ƾ���ơ���������b��������ѹ��ͨ����ƽ��ѹǿ�������װ���Ƿ���ڶ�������Ϊ�ƾ����ƽ��ѹǿ�����װ���Ƿ���ڶ�����
��2������ʵ��Ŀ�ĺ�ʵ��ԭ�������Ӻ�װ�ã����װ�õ������Ժ�Ӧ���еIJ���Ϊ��װ��A��B��C��D�зֱ������Ӧ���Լ�������K��ͨ��һ��ʱ��N2���ž�װ���еĿ������ٹرջ���K������ʢ������ˮ�������ܣ���ȼװ��B���ƾ����Ԥ��ľ̿�ۣ��Է�ֹˮ��������Ӳ�ʲ����ܺ�������ʹľ̿�۳�ʪ������ˮ������Ӧ��Ȼ���ȼװ��A���ƾ��ƣ��ṩˮ��������װ��B��ľ̿����ȫ��Ӧ��ֹͣ���ȣ�����ȷ��ʵ�鲽��Ϊ�٢ۢڢܢ�����Ϊ�٢ۢڢܢ���
��3��װ��B��Ӳ�ʲ������п��ܷ���C��ˮ�����ڸ�������������CO��H2�ķ�Ӧ��C��ˮ�����ڸ�������������CO2��H2�ķ�Ӧ���仯ѧ����ʽ�ֱ�ΪC+H2O��g��![]() CO+H2��C+2H2O��g��
CO+H2��C+2H2O��g��![]() CO2+2H2��
CO2+2H2��
��4����ȡ�����ܶ���ʱ��Ӧע�������Ϊ��ȴ�����¡�����������������Һ����ƽ��ƽ�Ӷ����������Ӷ�ȡ��ʼ�����������ƫ����������������ƫ��Ϊ����������������Һ����ƽ ƫ��
��5�������ȵı�ɫ��ΧΪ3.14.4���ʴﵽ�ζ��յ�ʱ������Ϊ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ����Ϊ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
��������Ϣ֪����Ӧ���ɵ�n��CO2��=��V1��l0-3 L��0.1000molL-l-V3��10-3L��0.1000molL-1��/2=![]() mol��mgľ̿��������n��C��=
mol��mgľ̿��������n��C��=![]() mol����̼ԭ���غ�֪��������������N��CO��=[
mol����̼ԭ���غ�֪��������������N��CO��=[![]() ]mol=
]mol=![]() mol���ɻ�ѧ����ʽC+2H2O��g��
mol���ɻ�ѧ����ʽC+2H2O��g��![]() CO2+2H2�������H2�����۲���Ϊ��
CO2+2H2�������H2�����۲���Ϊ��![]() ��2��mol=
��2��mol=![]() mol����H2�IJ���Ϊ
mol����H2�IJ���Ϊ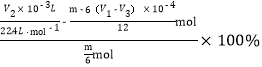 ��
��
��ͨ���ⶨϴ��������BaCO3���������ɵó����� ��CO2����������һ�������H2�IJ��ʡ���Ϊ�ⶨϴ��������BaCO3��������
����װ�����Ȳ����Ȼ�װ��������ѹǿ��Сʱ����������������Ϊȱ�ٷ�����װ�á�