题目内容
5.(1)写出下列微粒的结构示意图Mg
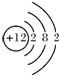 ,Cl-
,Cl-
(2)已知某元素的阴离子R-,其原子的质量数为127,中子数为74,则R-核外电子数为54.
(3)12.4g Na2R中含Na+0.4mol,则Na2R的摩尔质量为62g/mol.
分析 (1)Mg原子序数为12,核外有3个电子层,最外层电子数为2,Cl为17号元素,得到1个电子形成离子;
(2)质量数=质子数+中子数,阴离子的电子数=质子数+带电荷数;
(3)12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,结合M=$\frac{m}{n}$计算.
解答 解:(1)Mg原子序数为12,核外有3个电子层,最外层电子数为2,原子结构示意图为: ,Cl为17号元素,得到1个电子形成离子,Cl-的结构示意图为:
,Cl为17号元素,得到1个电子形成离子,Cl-的结构示意图为: ,故答案为:
,故答案为: ;
; ;
;
(2)R原子的质量数为127,中子数为74,则质子数=127-74=53,R-为带1个负电荷的阴离子,故电子数=53+1=54,故答案为:54;
(3)12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,M=$\frac{m}{n}$=$\frac{12.4g}{0.2mol}$=62g/mol,故答案为:62g/mol.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列叙述正确的是( )
| A. | 1molH2O的质量是18g/mol | |
| B. | CH4的摩尔质量是16g | |
| C. | 3.01×1023个CO2分子的质量是22g | |
| D. | 标准状况下,1mol任何物质的体积均为22.4L |
13.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法正确的是( )


| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
20.下列所述实验操作中,正确的是( )
| A. | 测定溶液的pH时,先将pH试纸用蒸馏水润湿,再测量 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,先向烧瓶中加入几片碎瓷片,再加热 | |
| C. | 分液时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
10.下列实验方法,能达到目的是( )
| A. | 用托盘天平称量25.20 g氯化钠固体 | |
| B. | 将干燥的氯气依次通过干燥红色布条和湿润红色布条检验氯气能否与水发生反应 | |
| C. | 用饱和溶液FeCl3和NaOH溶液混合制备Fe(0H)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
17.已知分解1molH2O2放出热量98kJ.在含有少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO-
H2O2+IO-→H2O+O2+I-.
下列有关该反应的说法不正确的是( )
H2O2+I-→H2O+IO-
H2O2+IO-→H2O+O2+I-.
下列有关该反应的说法不正确的是( )
| A. | H2O2(l)═2H2O(g)+O2(g)△H=-196kJ•mol-1 | |
| B. | 在该反应中H2O2既做氧化剂.又做还原剂 | |
| C. | 反应速率与I-浓度有关 | |
| D. | v(H2O2)=v(H2O)=v(O2) |
14.化学与生活密切相关,下列说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | B. | 硅胶可作袋装食品的干燥剂 | ||
| C. | 二氧化硫可作食品的漂白剂 | D. | 氢氧化铝可作胃酸的中和剂 |
15.下列说法中,正确的是( )
| A. | 22.4 L N2含阿伏加德罗常数个氮分子 | |
| B. | 在标准状况下,22.4 L水的质量约为18 g | |
| C. | 22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数 | |
| D. | 标准状况下,相同体积的任何气体单质所含的原子数相同 |
 某高聚物的单体A(C11H12O2)可发生如图变化:
某高聚物的单体A(C11H12O2)可发生如图变化: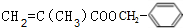 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.