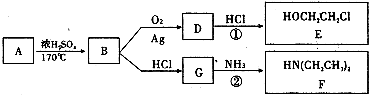
题目内容
【化学—选修5:物质结构与性质】(15分)
现有A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期。A元素原子的价层电子总数是内层电子总数的2倍;C元素原子的L电子层中只有两对成对电子;D元素与E元素在同周期相邻的族,它们的原子序数相差3,且D元素的基态原子有4个未成对电子。请回答下列问题:
⑴A、B、C三种元素的名称分别为 、 、 。
⑵用元素符号表示A、B、C三种元素的第一电离能由低到高的排序为 。
⑶E元素基态原子的核外电子排布式为 。
⑷A元素与氢元素能形成种类繁多的化合物,其中只含sp3杂化且相对分子质量最小的分子的VSEPR空间构型为 ;其中只含sp2杂化且相对分子质量最小的化合物的结构式为 ;其中同时含sp杂化、SP2杂化、sp3杂化且相对分子质量最小的化合物的化学式为 。
⑸A元素的一种单质的晶体结构如图甲所示,D元素的一种单质的晶体结构如图乙所示。

图甲中A原子的配位数与图乙中D原子的配位数之比为 。
⑴碳(1分)、氮(1分)、氧(1分)⑵C、O、N(2分)⑶[Ar]3d104s1(2分)⑷正四面体(2分)、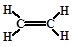 (2分),C5H6(2分)⑸1/2(2分)
(2分),C5H6(2分)⑸1/2(2分)
解析

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】