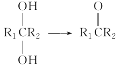题目内容
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中的原子序数依次增大的同主族元素。回答下列问题:
(1)N2的电子式为_________;锑在元素周期表中的位置为__________。
(2)![]() 中子数与质子数的差值为________。
中子数与质子数的差值为________。
(3)酸性:H3AsO4__H3PO4(填“>”或”<”)请从元素性质角度解释原因_______。
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是______元酸(填“一”、“二”或“三”)。
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为__。
【答案】![]() 第五周期第ⅤA族 43 < As元素的非金属性比P元素的弱 一 4:1
第五周期第ⅤA族 43 < As元素的非金属性比P元素的弱 一 4:1
【解析】
(1)氮气分子中含有1个氮氮三键,N最外层满足8电子稳定结构;氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素,结合N在周期表中位置分析;
(2)质量数=质子数+中子数,元素符号左上角为质量数、左下角为质子数;
(3)非金属性越强,最高价氧化物对应水化物的酸性越强;
(4)①H3PO2与足量的NaOH溶液反应生成NaH2PO2,说明该酸为一元酸;
②结合化合价升降相等计算氧化剂与还原剂的物质的量之比。
(1)氮气分子中,,每个氮原子都达到了8电子结构,氮气的电子式为![]() ;氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素,N位于第二周期ⅤA族,则锑(Sb)位于第五周期第ⅤA族,故答案为:
;氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素,N位于第二周期ⅤA族,则锑(Sb)位于第五周期第ⅤA族,故答案为:![]() ;第五周期第ⅤA族;
;第五周期第ⅤA族;
(2)![]() 的质量数为209,质子数为83,则中子数与质子数的差值为(20983)83=43,故答案为:43;
的质量数为209,质子数为83,则中子数与质子数的差值为(20983)83=43,故答案为:43;
(3)由于As的非金属性比P元素弱,则最高价含氧酸的酸性:H3AsO4<H3PO4,故答案为:<;As的非金属性比P元素弱;
(4)①H3PO2与足量的NaOH溶液反应生成NaH2PO2,说明NaH2PO2为正盐,则H3PO2为一元酸,故答案为:一;
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4,银元素化合价从+1价变为0价,化合价降低1价,银离子为氧化剂;
H3PO2中P元素化合价从+1价变为+5价,化合价升高4价,氧化还原反应中化合价升降相等,则利用H3PO2进行化学镀银时,氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案